【题目】将固体NH4I置于密闭容器中,在一定温度下发生下列反应:①NH4I(s)NH3(g)+HI(g);②2HI(g)H2(g)+I2(g).达到平衡时,c(H2)=0.5mol/L,c(HI)=4mol/L,则此温度下反应①的平衡常数为( )
A.9
B.16
C.20
D.25
参考答案:
【答案】C
【解析】平衡时c(HI)=4molL﹣1,HI分解生成的H2的浓度为0.5molL﹣1.
NH4I分解生成的HI的浓度为4molL﹣1+2×0.5molL﹣1=5molL﹣1,所以NH4I分解生成的NH3的浓度为5molL﹣1,
所以反应①的平衡常数k=c(NH3)c(HI)=5molL﹣1×4molL﹣1=20mol2L﹣2.
故答案为:C
由题干中H2、HI的浓度,结合三段式确定平衡时各物质的物质的量浓度,再结合公式![]() 计算。
计算。
-
科目: 来源: 题型:
查看答案和解析>>【题目】已知反应A+B
 C+D的能量变化如图所示,下列说法正确的是
C+D的能量变化如图所示,下列说法正确的是
A. 产物C的能量高于反应物的总能量
B. 若该反应中有电子得失,则可设计成原电池
C. 反应物的总能量低于生成物的总能量
D. 该反应中的反应物A和B的转化率定相同
-
科目: 来源: 题型:
查看答案和解析>>【题目】高温下,某反应平衡常数K=
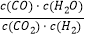 .恒容条件下达到平衡时,温度升高H2浓度减小.下列说法正确的是( )
.恒容条件下达到平衡时,温度升高H2浓度减小.下列说法正确的是( )
A.该反应的化学方程式为CO+H2O CO2+H2
CO2+H2
B.该反应的焓变为正值
C.恒温恒容下,增大压强,H2浓度一定减小
D.升高温度,平衡右移,逆反应速率减小 -
科目: 来源: 题型:
查看答案和解析>>【题目】常温下,将NaOH溶液滴加到某一元酸(HA)溶液中,测得混合溶液的pH与离子浓度变化关系如下图所示【已知:P[c(A-)/c(HA)]=-1g[c(A-)/c(HA)]】。下列叙述不正确的是
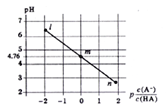
A. Ka(HA)的数量级为10-5
B. 滴加NaOH溶液过程中,c(A-)/[c(HA)×c(OH-)]保持不变
C. m点所示溶液中:c(H+)=c(HA)+c(OH-)-c(Na+)
D. n点所示溶液中:c(Na+)=c(A-)+c(HA)
-
科目: 来源: 题型:
查看答案和解析>>【题目】具有漂白作用的物质有:①84 消毒液 ②二氧化硫 ③过氧化氢 ④漂白粉,其漂白原理相同的是
A.①③B.②③C.①③④D.①②④
-
科目: 来源: 题型:
查看答案和解析>>【题目】设NA为阿伏伽德罗常数的值。下列说法正确的是
A. 标准状况下,5.6L.Cl2与足量NaOH反应转移的电子数为0.25NA
B. 室温下,1LpH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA
C. 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA
D. 5NH4NO3
 2HNO3+4N2↑+9H2O反应中,生成56gN2时,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应中,生成56gN2时,转移的电子数目为3.75NA -
科目: 来源: 题型:
查看答案和解析>>【题目】下列说法不正确的是
A. 反应MgO(s)+C(s)=Mg(s)+CO(g)在室温下不能自发进行,则该反应的△H>0
B. 原电池输出电能的能力取决于组成原电池的反应物的氧化还原能力
C. 0.1 mol·L-1CH3COOH溶液加水稀释后,溶液中
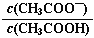 的值减小
的值减小D. 锅炉中沉积的CaSO4可用饱和Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去
相关试题

