【题目】我国化学专家侯德榜(下图)改革国外的纯碱生产工艺,生产流程可简要表示如下:
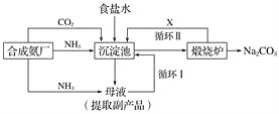

(1)上述生产纯碱的方法称__________,副产品的一种用途为______________。
(2)沉淀池中发生的化学反应方程式是______________。
(3)写出上述流程中X物质的分子式______________。
(4)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了____________(填上述流程中的编号)的循环。从沉淀池中取出沉淀的操作是________________。
(5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加__________________。
参考答案:
【答案】联合制碱法或侯氏制碱法 化肥或电解液或焊药等(其他合理答案均正确) NH3+CO2+H2O+NaCl===NH4Cl+NaHCO3↓或NH3+CO2+H2O===NH4HCO3、NH4HCO3+NaCl===NaHCO3↓+NH4Cl CO2 Ⅰ 过滤 稀硝酸和硝酸银溶液
【解析】
(1)目前工业制碱方法有二:氨碱法和联合制碱法.题中方法是由侯德榜所创,称为侯氏制碱法,也称为联合制碱法,反应方程式为NH3+CO2+H2O+NaCl===NH4Cl+NaHCO3↓,故副产物为氯化铵,氯化铵可用来制作化肥,
因此,本题正确答案是:联合制碱法或侯氏制碱法,做化肥;
(2)沉淀池中发生的化学反应为饱和食盐水中通入氨气和二氧化碳析出碳酸氢钠晶体,反应方程式为NH3+CO2+H2O+NaCl===NH4Cl+NaHCO3↓或NH3+CO2+H2O===NH4HCO3、NH4HCO3+NaCl===NaHCO3↓+NH4Cl ;
因此,本题正确答案是:.NH3+CO2+H2O+NaCl===NH4Cl+NaHCO3↓或NH3+CO2+H2O===NH4HCO3、NH4HCO3+NaCl===NaHCO3↓+NH4Cl ;
(3)在联合制碱法中x是煅烧碳酸氢钠制得的产物,可以循环利用,所以该产物为二氧化碳,因此,本题正确答案是: CO2;
(4)循环Ⅰ是将未反应的氯化钠返回沉淀池中,从固液混合物中分离出固体的方法为过滤.因此,本题正确答案是:循环Ⅰ,过滤;
(5)检验产品碳酸钠中是否含有氯化钠即检验是否含氯离子,可取少量试样溶于水后,再滴加硝酸酸化的硝酸银,观察若产生白色沉淀则说明有氯化钠存在,因此,本题正确答案是:用硝酸酸化的硝酸银,观察产生白色沉淀;
-
科目: 来源: 题型:
查看答案和解析>>【题目】向体积为2
 的容器中加入1
的容器中加入1 N2和6molH2进行可逆反应:N2(g)+3H2(g)
N2和6molH2进行可逆反应:N2(g)+3H2(g) 2NH3(g),2
2NH3(g),2 后测得N2的物质的量为0.6mol,则:
后测得N2的物质的量为0.6mol,则:(1)2
 内,H2的物质的量减少了_______mol,NH3的物质量增加了______mol。
内,H2的物质的量减少了_______mol,NH3的物质量增加了______mol。(2)若用N2的浓度变化来表示该反应的反应速率为__________mol/(L·min)。
(3)若用NH3的浓度变化来表示该反应的反应速率为_________ mol/(L·min)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】短周期元素A、B、C在元素周期表中的位置如图所示,已知A、B、C三种元素的原子核外电子数之和等于B的质子数的2倍。据此回答下列问题:
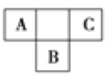
(1)A的气态氢化物的化学式为_________。
(2)B的元素符号为__________,在周期表中位于___________________。
(3)C的单质的化学式为__________,其氢化物的水溶液可用于雕刻玻璃。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列实验方案能达到相应实验目的的是
选项
实验目的
实验方案
A
分离Fe2O3、Al2O3
将混合物投入足量NaOH溶液中然后依次进行过滤、洗涤、蒸发、灼烧四项操作
B
验证淀粉溶液水解生成葡萄糖
向淀粉溶液中加入稀硫酸共热,冷却后再加入新制Cu(OH)2悬浊液,加热
C
制备无水AlCl3
蒸发铝与稀盐酸反应后的溶液
D
检验FeCl2晶体是否完全变质
取少量久置的FeCl2晶体于试管中,逐滴加入酸性高锰酸钾溶液
A. A B. B C. C D. D
-
科目: 来源: 题型:
查看答案和解析>>【题目】某可逆反应从0~2分钟进行过程中,在不同反应时间各物质的量的变化情况如下图所示。
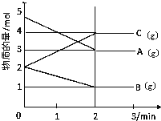
(1)则该反应的化学方程式为__________________;
(2)反应开始至2分钟时,能否用C表示反应速率?_____(填能或不能)。若能,其反应速率为 ;若不能,则其原因为__________;
(3)2分钟后A、B、C各物质的量不再随时间的变化而变化,则此时v正(B)与v逆(C)的等量关系是______________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】已知A的产量通常用来衡量一个国家的石油化工水平,现以A为主要原料合成一种具有果香味的物质E,其合成路线如图所示.
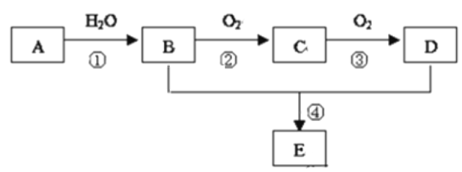
请回答下列问题:
(1)写出A的电子式______________;
(2)D、E分子中官能团的名称是_______、 _________;
(3)写出下列反应的化学方程式:
②_______________________________________,反应类型:____________。
④_______________________________________,反应类型_____________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】分析锌锰电池构造示意图,回答下列问题:
(1)普通锌锰电池的构造如图(a)所示。

①该电池的负极材料是________。电池工作时,电子流向________(填“正极”或“负极”)。
②若电解质含有杂质Cu2+,会加速某电极的腐蚀。其主要原因是____________。
③普通锌锰电池的缺点有_____________。
(2)碱性锌锰电池的构造如图(b)所示。与普通锌锰电池相比,碱性锌锰电池的优点及其理由是_________________。

相关试题

