【题目】已知A的产量通常用来衡量一个国家的石油化工水平,现以A为主要原料合成一种具有果香味的物质E,其合成路线如图所示.
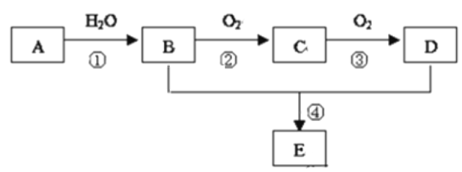
请回答下列问题:
(1)写出A的电子式______________;
(2)D、E分子中官能团的名称是_______、 _________;
(3)写出下列反应的化学方程式:
②_______________________________________,反应类型:____________。
④_______________________________________,反应类型_____________。
参考答案:
【答案】![]() 羧基酯基2CH3CH2OH+O2
羧基酯基2CH3CH2OH+O2![]() 2CH3CHO+2H2O氧化反应CH3COOH+CH3CH2OH
2CH3CHO+2H2O氧化反应CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O酯化反应或取代反应
CH3COOCH2CH3+H2O酯化反应或取代反应
【解析】
A的产量通常用来衡量一个国家的石油化工水平,则A为CH2=CH2,A和水发生加成反应生成B为CH3CH2OH,B被氧化生成C为CH3CHO,C被氧化生成D为CH3COOH,E是具有果香味的物质,且B和D发生酯化反应生成E,因此E为CH3COOCH2CH3。据此解答。
根据以上分析可知A为CH2=CH2,B为CH3CH2OH,C为CH3CHO,D为CH3COOH,E为CH3COOCH2CH3。则
(1)乙烯分子中含有共价键,电子式为![]() ;
;
(2)D、E分别是乙酸和乙酸乙酯,分子中官能团的名称分别是羧基、酯基;
(3)②为乙醇的催化氧化,方程式为2CH3CH2OH+O2![]() 2CH3CHO+2H2O,属于氧化反应;④为酯化反应,方程式为CH3COOH+CH3CH2OH
2CH3CHO+2H2O,属于氧化反应;④为酯化反应,方程式为CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O。
CH3COOCH2CH3+H2O。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列实验方案能达到相应实验目的的是
选项
实验目的
实验方案
A
分离Fe2O3、Al2O3
将混合物投入足量NaOH溶液中然后依次进行过滤、洗涤、蒸发、灼烧四项操作
B
验证淀粉溶液水解生成葡萄糖
向淀粉溶液中加入稀硫酸共热,冷却后再加入新制Cu(OH)2悬浊液,加热
C
制备无水AlCl3
蒸发铝与稀盐酸反应后的溶液
D
检验FeCl2晶体是否完全变质
取少量久置的FeCl2晶体于试管中,逐滴加入酸性高锰酸钾溶液
A. A B. B C. C D. D
-
科目: 来源: 题型:
查看答案和解析>>【题目】我国化学专家侯德榜(下图)改革国外的纯碱生产工艺,生产流程可简要表示如下:
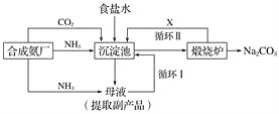

(1)上述生产纯碱的方法称__________,副产品的一种用途为______________。
(2)沉淀池中发生的化学反应方程式是______________。
(3)写出上述流程中X物质的分子式______________。
(4)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了____________(填上述流程中的编号)的循环。从沉淀池中取出沉淀的操作是________________。
(5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加__________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某可逆反应从0~2分钟进行过程中,在不同反应时间各物质的量的变化情况如下图所示。
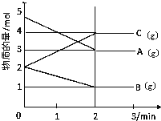
(1)则该反应的化学方程式为__________________;
(2)反应开始至2分钟时,能否用C表示反应速率?_____(填能或不能)。若能,其反应速率为 ;若不能,则其原因为__________;
(3)2分钟后A、B、C各物质的量不再随时间的变化而变化,则此时v正(B)与v逆(C)的等量关系是______________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】分析锌锰电池构造示意图,回答下列问题:
(1)普通锌锰电池的构造如图(a)所示。

①该电池的负极材料是________。电池工作时,电子流向________(填“正极”或“负极”)。
②若电解质含有杂质Cu2+,会加速某电极的腐蚀。其主要原因是____________。
③普通锌锰电池的缺点有_____________。
(2)碱性锌锰电池的构造如图(b)所示。与普通锌锰电池相比,碱性锌锰电池的优点及其理由是_________________。

-
科目: 来源: 题型:
查看答案和解析>>【题目】某化学兴趣小组利用NaI溶液中通入少量Cl2得到含碘废液,再利用含碘废液获取NaI固体,实验流程如下:

已知反应②:2I﹣+2Cu2++
 +H2O
+H2O 2CuI↓+
2CuI↓+ +2H+。
+2H+。回答下列问题:
(1)过滤实验所需要的玻璃仪器有普通漏斗、烧杯、_____________。
(2)反应③中CuI被氧化,还原产物只有NO2,该反应的化学方程式为_________________。当有95.5 g CuI参与反应,则需要标况下______________L的O2才能将生成的NO2在水中完全转化为硝酸。
(3)化合物B中含两种元素,铁原子与另一种元素原子的物质的量之比为3∶8,则化合物B的化学式为_____________。
(4)反应⑤中生成黑色固体和无色气体,黑色固体的俗称为磁性氧化铁,则反应⑤的化学方程式为______。
(5)将足量的Cl2通入含12 g NaI的溶液中,一段时间后把溶液蒸干得到固体的质量为_________g。
-
科目: 来源: 题型:
查看答案和解析>>【题目】1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.18g·cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验室中可以用如图所示装置制备1,2-二溴乙烷。其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水)。

填写下列空白:
(1)写出本题中制备1,2-二溴乙烷的两个化学方程式____________;
(2)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞。请写出发生堵塞时瓶b中的现象__________________。
(3)容器c中NaOH溶液的作用是____________________。
(4)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超过许多。如果装置的气密性没有问题,试分析其可能的原因。①________________________、②_________________。
相关试题

