【题目】向体积为2![]() 的容器中加入1
的容器中加入1![]() N2和6molH2进行可逆反应:N2(g)+3H2(g)
N2和6molH2进行可逆反应:N2(g)+3H2(g)![]() 2NH3(g),2
2NH3(g),2![]() 后测得N2的物质的量为0.6mol,则:
后测得N2的物质的量为0.6mol,则:
(1)2![]() 内,H2的物质的量减少了_______mol,NH3的物质量增加了______mol。
内,H2的物质的量减少了_______mol,NH3的物质量增加了______mol。
(2)若用N2的浓度变化来表示该反应的反应速率为__________mol/(L·min)。
(3)若用NH3的浓度变化来表示该反应的反应速率为_________ mol/(L·min)。
参考答案:
【答案】1.2 0.8 0.1 0.2
【解析】
依据化学平衡的三段式列式计算得到2min后的物质的量,从而计算H2、NH3的物质的量的变化量,根据v=![]() 计算v(N2)和v(NH3)。
计算v(N2)和v(NH3)。
向体积为2L的容器中加入1mol N2和6mol H2进行可逆反应:N2(g)+3H2(g)![]() 2NH3(g),反应2min后,测得N2的物质的量为0.6mol,则
2NH3(g),反应2min后,测得N2的物质的量为0.6mol,则
N2(g)+3H2(g)![]() 2NH3(g),
2NH3(g),
起始量(mol) 1 6 0
变化量(mol) 0.4 1.2 0.8
2![]() (mol) 0.6 4.4 0.8
(mol) 0.6 4.4 0.8
(1)2min内,H2的物质的量减少了1.2mol,NH3的物质的量增加了0.8mol;
(2)用N2的浓度变化来表示该反应的反应速率v(N2)=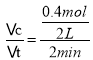 =0.1 mol/(L·min);
=0.1 mol/(L·min);
(3)用NH3的浓度变化来表示该反应的反应速率v(NH3)=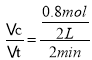 =0.2 mol/(L·min)。
=0.2 mol/(L·min)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列离子能大量共存的是( )
A.H+,Ag+,NO3-,Na+
B.Ca2+,Cl-,HCO3-,NO3-
C.Fe3+,SO42-,Cl-,OH-
D.H+,Cl-,Ac-,NH4+
-
科目: 来源: 题型:
查看答案和解析>>【题目】根据所学知识,回答问题:
Ⅰ.在第三周期元素及其单质和化合物中,氧化性最强的单质是__________,还原性最强的单质是__________;最高价氧化物对应的水化物中,最强的酸是__________,最强的碱是_________,形成的两性氢氧化物是__________;化学性质最稳定的元素是__________。
Ⅱ.(1)A元素原子的核电荷数为8,其原子核内的质子数为__________,该元素原子的二价阴离子的核外电子数为_________,中子数是8的核素表示为__________。
(2)B元素原子的一价阳离子的核外有10个电子,质量数为23,该元素原子的原子核内中子数为__________。
(3)A、B形成1:1型化合物的相对分子质量是__________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】A~J是中学化学中常见的物质,它们之间的转化关系如图所示(部分产物已略去)。已知A是一种高熔点物质,D是一种红棕固体,H的焰色呈黄色。

请回答下列问题:
(1)A物质的化学式为______________,H物质的名称为______________。
(2)G→J的实验现象是______________________________________________,化学方程式为____________________________。
(3)D与C高温下反应的化学方程式为____________________________。
(4)D物质与盐酸恰好反应的离子方程式为____________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】短周期元素A、B、C在元素周期表中的位置如图所示,已知A、B、C三种元素的原子核外电子数之和等于B的质子数的2倍。据此回答下列问题:
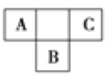
(1)A的气态氢化物的化学式为_________。
(2)B的元素符号为__________,在周期表中位于___________________。
(3)C的单质的化学式为__________,其氢化物的水溶液可用于雕刻玻璃。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列实验方案能达到相应实验目的的是
选项
实验目的
实验方案
A
分离Fe2O3、Al2O3
将混合物投入足量NaOH溶液中然后依次进行过滤、洗涤、蒸发、灼烧四项操作
B
验证淀粉溶液水解生成葡萄糖
向淀粉溶液中加入稀硫酸共热,冷却后再加入新制Cu(OH)2悬浊液,加热
C
制备无水AlCl3
蒸发铝与稀盐酸反应后的溶液
D
检验FeCl2晶体是否完全变质
取少量久置的FeCl2晶体于试管中,逐滴加入酸性高锰酸钾溶液
A. A B. B C. C D. D
-
科目: 来源: 题型:
查看答案和解析>>【题目】我国化学专家侯德榜(下图)改革国外的纯碱生产工艺,生产流程可简要表示如下:
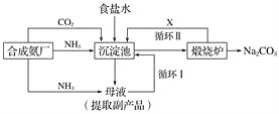

(1)上述生产纯碱的方法称__________,副产品的一种用途为______________。
(2)沉淀池中发生的化学反应方程式是______________。
(3)写出上述流程中X物质的分子式______________。
(4)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了____________(填上述流程中的编号)的循环。从沉淀池中取出沉淀的操作是________________。
(5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加__________________。
相关试题

