【题目】如图所示,组成一个原电池。
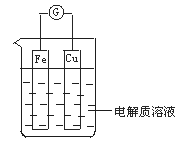
(1)当电解质溶液为稀硫酸时:
①Fe电极是__(填“正”或“负”)极,其电极反应为___。
②Cu电极是__极,其电极反应为___。
(2)由铜、锌和稀硫酸组成的原电池中,铜是__极,电极反应式是__;锌是__极,电极反应式是___。
参考答案:
【答案】负 Fe-2e-=Fe2+ 正 2H++2e-=H2↑ 正 2H++2e-=H2↑ 负 Zn-2e-=Zn2+
【解析】
(1)当电解质溶液为稀硫酸时,铁比铜活泼,为负极,电极反应式为:Fe-2e-=Fe2+;铜是正极,溶液中的H+得到电子,电极反应式为:2H++2e-=H2↑,故答案为:负;Fe-2e-=Fe2+;正;2H++2e-=H2↑;
(2)由铜、锌和稀硫酸组成的原电池中,由于锌比铜活泼,所以锌是负极,电极反应式为:Zn-2e-=Zn2+,铜是正极,电极反应式为2H++2e-=H2↑,故答案为:正;2H++2e-=H2↑;负;Zn-2e-=Zn2+。
-
科目: 来源: 题型:
查看答案和解析>>【题目】Ⅰ.实验室用需配制230mL 0.1mol/L的Na2CO3溶液,填空并请回答下列问题:
(1)实际用托盘天平称Na2CO3质量______________;
(2)应选用容量瓶的规格为:_________,除容量瓶外还需要的其它仪器:______;
(3)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)___________;
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.用托盘天平准确称量取所需的Na2CO3的质量,放入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其完全溶解
C.将已冷却的Na2CO3溶液沿玻璃棒注入一定规格的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
(4)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)
①若没有进行A操作_______________;
②若加蒸馏水时不慎超过了刻度_______________。
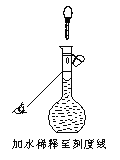
Ⅱ.实验室需配制250 mL 0.1 mol/L的醋酸(CH3COOH),现有36%的醋酸,密度为1.04g/mL,按要求回答下列问题:
(1)需要量筒取用36%的醋酸________ mL进行配制;
(2)若配制时仅有其中一步操作(如图所示)有错误,其他操作全部正确,则所配醋酸的浓度___________(填“正确”、“偏高”或“偏低”)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某研究小组拟合成染料X和医药中间体Y。

已知:
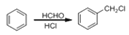
CH3CH2Cl
 CH3CH2CNCH3CH2COOH
CH3CH2CNCH3CH2COOH(1)下列说法正确的是______
A.化合物A能与FeCl3溶液发生显色反应B.化合物E具有弱碱性
C.化合物X能发生加成、取代、还原反应
D.化合物Y的分子式为C20H23NO4
(2)化合物C的结构简式______
(3)写出D+E→X的化学反应方程式______
(4)写出同时符合下列条件的B的同分异构体的结构简式______
1H-NMR谱和IR谱检测表明:
①分子中有4种化学环境不同的氢原子;
②分子中含有苯环、甲氧基(-OCH3),-CH2Cl
(5)请设计以苯和乙烯为原料制备
 的合成路线(用流程图表示,无机试剂任选)。合成路线流程图示例如下:CH3CH2OHCH3CHOCH3COOH______________
的合成路线(用流程图表示,无机试剂任选)。合成路线流程图示例如下:CH3CH2OHCH3CHOCH3COOH______________ -
科目: 来源: 题型:
查看答案和解析>>【题目】为探究某矿物的主要成分X(仅含三种元素)的组成,某兴趣小组进行了如下实验:
①取55.2g固体X在空气存在下高温煅烧,有刺激性气味的气体产生(标况下为13.44L),该气体能使品红溶液褪色。
②高温煅烧后的固体用磁分离技术进行分离,得到19.2g红色固体单质和23.2g黑色固体。
③将23.2g固体溶于稀硫酸,再加氢氧化钠,将所得沉淀充分灼烧,得到24g红棕色固体。已知各步反应试剂均过量,请回答:
(1)X化学式为______
(2)写出X在空气存在下高温煅烧的化学反应方程式______
(3)写出X高温煅烧后的气体通入碘水中发生的离子反应方程式______
-
科目: 来源: 题型:
查看答案和解析>>【题目】A、B、C、D为短周期元素,请根据下表信息回答问题。
元素
A
B
C
D
性质或结构信息
工业上通过分离液态空气获得其单质,单质能助燃
气态氢化物显碱性
+3价阳离子的核外电子排布与氖原子相同
第三周期原子半径最小
(1)B在元素周期表的位置:___;B气态氢化物的电子式___。
(2)C的最高价氧化物分别与强酸、强碱反应的离子方程式为___、___。
-
科目: 来源: 题型:
查看答案和解析>>【题目】以含锂电解铝废渣(主要含 AlF3、 NaF、LiF、CaO ) 和浓硫酸为原料,制备电池级碳酸锂,同时得副产品冰晶石,其工艺流程如下:

已知LiOH易溶于水,Li2CO3微溶于水。回答下列问题:
(1)电解铝废渣与浓硫酸反应产生的气体化学式为 ___________。滤渣2的主要成分是(写化学式)_________。
(2)碱解反应中, 同时得到气体和沉淀反应的离子方程式为_____________。
(3)一般地说 K>105 时,该反应进行得就基本完全了。苛化反应中存在如下平衡:Li2CO3(s)+Ca2+(aq)2Li+(aq)+ CaCO3(s)通过计算说明该反应是否进行完全________(已知Ksp(Li2CO3) = 8.64×10-4、Ksp(CaCO3) = 2.5×10-9)。
(4)碳化反应后的溶液得到Li2CO3的具体实验操作有:加热浓缩、______、______、干燥。
(5)上述流程得到副产品冰晶石的化学方程式为__________。
(6)Li2CO3是制备金属锂的重要原料, 一种制备金属锂的新方法获得国家发明专利,其装置如图所示:

工作时电极 C 应连接电源的______极,阳极的电极反应式为__________ 。该方法设计的 A 区能避免熔融碳酸锂对设备的腐蚀和因________逸出对环境的污染。
-
科目: 来源: 题型:
查看答案和解析>>【题目】设NA为阿伏加德罗常数值。如图表示N2O在Pt2O+表面与CO反应转化成无害气体的过程。下列说法正确的是

A.N2O转化成无害气体时的催化剂是Pt2O2+
B.每1mol Pt2O+转化为Pt2O2+得电子数为3NA
C.将生成的CO2通人含大量SiO32-、Na+、Cl-的溶液中,无明显现象
D.1g CO2 、N2O的混合气体中含有电子数为0.5NA
相关试题

