【题目】Ⅰ.实验室用需配制230mL 0.1mol/L的Na2CO3溶液,填空并请回答下列问题:
(1)实际用托盘天平称Na2CO3质量______________;
(2)应选用容量瓶的规格为:_________,除容量瓶外还需要的其它仪器:______;
(3)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)___________;
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.用托盘天平准确称量取所需的Na2CO3的质量,放入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其完全溶解
C.将已冷却的Na2CO3溶液沿玻璃棒注入一定规格的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
(4)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)
①若没有进行A操作_______________;
②若加蒸馏水时不慎超过了刻度_______________。
Ⅱ.实验室需配制250 mL 0.1 mol/L的醋酸(CH3COOH),现有36%的醋酸,密度为1.04g/mL,按要求回答下列问题:
(1)需要量筒取用36%的醋酸________ mL进行配制;
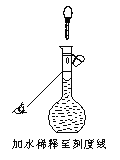
(2)若配制时仅有其中一步操作(如图所示)有错误,其他操作全部正确,则所配醋酸的浓度___________(填“正确”、“偏高”或“偏低”)。
参考答案:
【答案】2.7g 250mL 托盘天平、烧杯、玻璃棒、胶头滴管 B、C、A、F、E、D 偏低 偏低 4.0 偏低
【解析】
Ⅰ.配制230mL 0.1mol/L的Na2CO3溶液,应选用250mL的容量瓶,实验步骤,计算、称量、溶解、冷却、移液、洗涤、定容、摇匀;
Ⅱ.根据c=![]() 计算浓醋酸的浓度,根据c1×V1=c2×V2计算体积。
计算浓醋酸的浓度,根据c1×V1=c2×V2计算体积。
Ⅰ.(1)配制230mL 0.1mol/L的Na2CO3溶液,应选用250mL的容量瓶,配制250mL的溶液,则称量Na2CO3质量=c×V×M=0.1mol/L×0.25L×106g/mol=2.65g,需要称量2.7g;
(2)应选用容量瓶的规格为250mL;根据实验步骤,计算、称量、溶解、冷却、移液、洗涤、定容、摇匀,使用的仪器有:天平、量筒(可不选)、烧杯、玻璃棒、250mL的容量瓶、胶头滴管,答案为托盘天平、烧杯、玻璃棒、胶头滴管;
(3)配制时,根据实验步骤,计算、称量、溶解、冷却、移液、洗涤、定容、摇匀,则操作顺序为B、C、A、F、E、D;
(4)①若没有进行洗涤操作,导致配制溶液的溶质的物质的量偏小,则浓度偏低;
②若加蒸馏水时不慎超过了刻度,则导致溶液的体积偏大,浓度偏低;
Ⅱ.(1)36%的醋酸的浓度=![]() =
=![]() =6.24mol/L,V(CH3COOH)=
=6.24mol/L,V(CH3COOH)=![]() mL=4.0mL;
mL=4.0mL;
(2)根据图像可知,定容时仰视,则导致配制溶液的体积偏大,则溶液浓度偏低。
-
科目: 来源: 题型:
查看答案和解析>>【题目】NA表示阿伏加德罗常数,则下列说法正确的是( )
A. 0.1 mol/L K2SO4溶液含有K+ 0.2NA
B. 标准状况下,11.2L水所含的电子数为5NA
C. 常温常压下,16g O2含电子数为10NA
D. 0.1 mol Mg原子变成Mg2+时失去的电子数为0.2NA
-
科目: 来源: 题型:
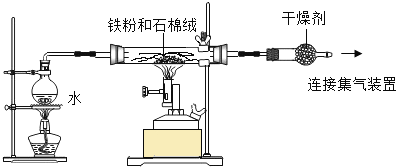
查看答案和解析>>【题目】某兴趣小组为了探究铁粉与水蒸气反应的产物,做了下面实验。
资料:在不同温度下,铁粉与水蒸气反应的产物不同。
Fe +H2O
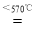 FeO+H2 3Fe + 4H2O
FeO+H2 3Fe + 4H2O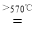 Fe3O4 + 4H2
Fe3O4 + 4H2实验一:某兴趣小组用下图所示装置,使铁粉与过量水蒸气充分反应并检验固体产物的组成。
(1)实验过程中,应先点燃___________(选填“酒精灯”或“酒精喷灯”);目的是__________________,装置中石棉绒的作用是_____________________。
(2)若在实验中的某段时间内生成H2 0.2g,则这段时间内参加反应的铁粉质量至少是___________g。
实验二:铁粉完全反应后,兴趣小组对硬质玻璃管中生成的FeO和Fe3O4的质量进行测定,实验流程如下图。
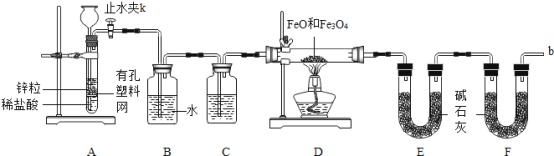
(1)实验前检查装置A的气密性:关闭止水夹K,从长颈漏斗向试管内加水,至长颈漏斗中管内的液面高于管外液面,静置一段时间,若液面高度差__________,则气密性良好。
(2)装置A中发生的反应方程式_______________________________________。
(3)为了安全,在点燃酒精灯之前,在F装置出口b处必须______________________。
(4)装置C中所放试剂为_________,装置B的作用是_________________________。
(5)干燥管E右边又连接干燥管F的目的是_________________________________。
若无干燥管F,测得Fe3O4的质量将_______________(填“偏大”、“偏小”或“无影响”)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列各物质中所含原子个数由大到小的顺序正确的是( )
①0.3molNH3 ②标准状况下22.4L氯气 ③9mL H2O (4℃) ④0.2mol H3PO4
A. ①④③② B. ④③②① C. ②④③① D. ①④②③
-
科目: 来源: 题型:
查看答案和解析>>【题目】某研究小组拟合成染料X和医药中间体Y。

已知:
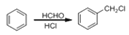
CH3CH2Cl
 CH3CH2CNCH3CH2COOH
CH3CH2CNCH3CH2COOH(1)下列说法正确的是______
A.化合物A能与FeCl3溶液发生显色反应B.化合物E具有弱碱性
C.化合物X能发生加成、取代、还原反应
D.化合物Y的分子式为C20H23NO4
(2)化合物C的结构简式______
(3)写出D+E→X的化学反应方程式______
(4)写出同时符合下列条件的B的同分异构体的结构简式______
1H-NMR谱和IR谱检测表明:
①分子中有4种化学环境不同的氢原子;
②分子中含有苯环、甲氧基(-OCH3),-CH2Cl
(5)请设计以苯和乙烯为原料制备
 的合成路线(用流程图表示,无机试剂任选)。合成路线流程图示例如下:CH3CH2OHCH3CHOCH3COOH______________
的合成路线(用流程图表示,无机试剂任选)。合成路线流程图示例如下:CH3CH2OHCH3CHOCH3COOH______________ -
科目: 来源: 题型:
查看答案和解析>>【题目】为探究某矿物的主要成分X(仅含三种元素)的组成,某兴趣小组进行了如下实验:
①取55.2g固体X在空气存在下高温煅烧,有刺激性气味的气体产生(标况下为13.44L),该气体能使品红溶液褪色。
②高温煅烧后的固体用磁分离技术进行分离,得到19.2g红色固体单质和23.2g黑色固体。
③将23.2g固体溶于稀硫酸,再加氢氧化钠,将所得沉淀充分灼烧,得到24g红棕色固体。已知各步反应试剂均过量,请回答:
(1)X化学式为______
(2)写出X在空气存在下高温煅烧的化学反应方程式______
(3)写出X高温煅烧后的气体通入碘水中发生的离子反应方程式______
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图所示,组成一个原电池。
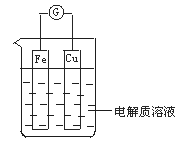
(1)当电解质溶液为稀硫酸时:
①Fe电极是__(填“正”或“负”)极,其电极反应为___。
②Cu电极是__极,其电极反应为___。
(2)由铜、锌和稀硫酸组成的原电池中,铜是__极,电极反应式是__;锌是__极,电极反应式是___。
相关试题

