【题目】能源危机是当前一个全球性问题。请回答下列问题:
(1)下列做法有助于能源“开源节流”的是_____________(填字母)。
a.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
b.大力开采煤、石油和天然气以满足人们日益增长的能源需求
c.减少资源消耗,注重资源的重复使用、资源的循环再生
(2)甲烷是一种优良的气体燃料。已知1g 甲烷完全燃烧生成CO2和H2O(l)过程中,放出55.6kJ 热量,写出表示甲烷燃烧热的热化学方程式:____________________________。
(3)已知稀溶液中,含30g溶质的醋酸溶液与NaOH 溶液恰好完全反应时,放出28.55kJ热量。写出表示醋酸与NaOH 反应的中和热的热化学方程式:___________________。
(4)已知: CH4(g)+2O2(g) =CO2(g)+2H2O(l) △H=-890.3kJmol-1
N2(g)+O2(g) ==2NO(g) △H=+180kJmol-1
CH4 可用于脱硝,其热化学方程式为CH4(g)+4NO(g)==CO2(g)+2N2(g)+2 H2O(l) △H=__________。
(5)如下图是298 K时N2与H2反应过程中能量变化的曲线图,该反应的热化学方程式为:_____________________________。

(6)已知断裂下列化学键需要吸收的能量分别为: H-H a kJmol-1\、H-O b kJmol-1、O=O c kJmol-1,根据有关数据估算氢气与氧气的反应:2H2+O2=2H2O 该反应的△H=_________________。
参考答案:
【答案】 ac CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-889.6kJ·mol-1 CH3COOH(aq) +NaOH(aq)=CH3COONa(aq)+H2O △H= -57.1kJ·mol-1 -1250.3 kJ·mol-1 N2(g)+2H2(g)=2NH3(g) △H=-92kJ·mol-1 (2a+c-4b)kJ·mol-1
【解析】本题主要考查反应热的计算。
(1)a.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源,有助于能源“开源节流”;b.大力开采煤、石油和天然气以满足人们日益增长的能源需求,不利于能源“开源节流”;c.减少资源消耗,注重资源的重复使用、资源的循环再生,有助于能源“开源节流”。故选ac。
(2)16g即1mol甲烷完全燃烧生成CO2和H2O(l)过程中,放出889.6kJ热量,表示甲烷燃烧热的热化学方程式:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-889.6kJ·mol-1。
(3)含30g即0.5mol溶质的醋酸溶液与NaOH 溶液恰好完全反应时,放出28.55kJ热量,表示醋酸与NaOH 反应的中和热的热化学方程式:CH3COOH(aq) +NaOH(aq)=CH3COONa(aq)+H2O △H= -57.1kJ·mol-1。
(4)将上述两个热化学方程式的反应热分别表示为△H1、△H2,△H=△H1-2△H2= -1250.3kJ·mol-1。
(5)△H=(508-600)KJ·mol-1=-92kJ·mol-1,该反应的热化学方程式为:N2(g)+2H2(g)=2NH3(g) △H=-92kJ·mol-1。
(6)△H=反应物键能之和-生成物键能之和=(2a+c-4b)kJ·mol-1。
-
科目: 来源: 题型:
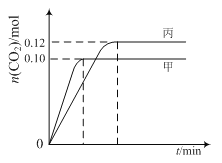
查看答案和解析>>【题目】一定温度下,在三个容积均为2.0 L的恒容密闭容器中发生反应:
2NO(g)+2CO(g)
 N2(g)+2CO2(g)
N2(g)+2CO2(g)各容器中起始物质的量与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随时间变化关系如图所示:
容器
温度/℃
起始物质的量/mol
NO (g)
CO (g)
甲
T1
0.20
0.20
乙
T1
0.30
0.30
丙
T2
0.20
0.20
下列说法正确的是
A. 该反应的正反应为吸热反应
B. 达到平衡时,乙中CO2的体积分数比甲中的小
C. T1℃时,若起始时向甲中充入0.40 mol NO、0.40mol CO、0.40mol N2和0.40mol CO2,则反应达到新平衡前v(正)>v(逆)
D. T2℃时,若起始时向丙中充入0.06mol N2和0.12 mol CO2,则达平衡时N2的转化率大于40%
-
科目: 来源: 题型:
查看答案和解析>>【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 1 mol NaHSO4熔融或溶于水时电离出的离子总数均为3NA
B. 17 g H2O2含有0.5NA个非极性共价键
C. 在1L0.5mol/LH2SO4溶液中,含有的氧原子数为2NA
D. 标准状况下,22.4 L Cl2溶于水转移的电子数为NA
-
科目: 来源: 题型:
查看答案和解析>>【题目】用如图装置制取表中的四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂)。其中正确的是( )

选项
气体
a
b
c
d
A
CO2
盐酸
CaCO3
饱和Na2CO溶液
浓硫酸
B
Cl2
浓盐酸
MnO2
NaOH溶液
浓硫酸
C
NH3
饱和NH4Cl溶液
消石灰
H2O
固体NaOH
D
NO
稀硝酸
铜屑
H2O
浓硫酸
A. A B. B C. C D. D
-
科目: 来源: 题型:
查看答案和解析>>【题目】113号元素的元素符号为Nh,中文名称为“弥”,是一种人工合成的放射性化学元素,下列有关该元素的说法中错误的是
A.位于第七周期第ⅢA族
B.化学反应中单质Nh可作氧化剂
C.相同条件下与稀硫酸反应时Nh比A1剧烈
D.最高价氧化物为Nh2O3
-
科目: 来源: 题型:
查看答案和解析>>【题目】根据所学知识完成题目:
(1)有以下10种物质:①铁 ②稀硫酸 ③氯化氢 ④氨气 ⑤空气 ⑥二氧化碳 ⑦水银 ⑧氯化镁 ⑨硫酸钡=10 ⑩蔗糖.其中属于电解质的是 .
(2)写出⑧在水溶液中的电离方程式 .
(3)写出①与水蒸气反应的化学方程式 . -
科目: 来源: 题型:
查看答案和解析>>【题目】为了探究外界条件对H2O2分解速率的影响,有同学利用实验室提供的仪器和试剂进行了如下实验,请填写下列空白:
试剂:5%H2O2 溶液,10%H2O2 溶液,1mol·L-1FeCl3 溶液
仪器: 试管、胶头滴管、酒精灯
(1)实验目的:探究温度对化学反应速率的影响
实验步骤:分别向A、B 两支试管中加5 mL 5 % H2O2溶液,将试管A 放入5℃ 水浴中,将试管B 放入40℃水浴中,同时分别向两试管中加入2~3 滴1mol·L-1FeCl3 溶液,观察实验现象。
实验现象:试管_________(填A 或B)中产生气泡的速率快,说明_________________。
(2)实验目的:探究浓度对化学反应速率的影响
实验步骤:向试管A 中加入5 mL5%H2O2溶液,向试管B 中加入5 mL10%H2O2溶液,观察实验现象。
实验现象:试管A、B 中均有少量气体缓慢产生。
请你改进实验方案,使该实验的实验现象更为明显,以支撑“浓度改变会影响化学反应速率”这一理论预测。______________________________________
(3)实验目的:____________________________。
实验步骤:分别向试管A 和B 中加入5 mL 5%H2O2溶液后,再向试管B 中加入1mol·L-1FeCl3 溶液,观察实验现象。
你认为方案(3) 的设计是否严谨?_______(填是或否),说明理由___________________。
(4)下列有关影响化学反应速率的因素的说法错误的是__________(填字母)。
a.对于已经达到化学平衡状态的反应A(g)
 B(g)+C(g) △H >0,其他条件不变时,升高温度,正反应速率增大,逆反应速率减小,所以平衡正向移动
B(g)+C(g) △H >0,其他条件不变时,升高温度,正反应速率增大,逆反应速率减小,所以平衡正向移动b.其他条件不变时,增大压强一定能加快化学反应速率
c.其他条件不变时,使用正催化剂,活化分子百分数增大,化学反应速率加快
相关试题

