【题目】一定温度下,在三个容积均为2.0 L的恒容密闭容器中发生反应:
2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
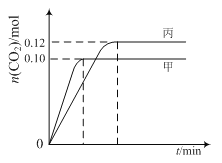
各容器中起始物质的量与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随时间变化关系如图所示:
容器 | 温度/℃ | 起始物质的量/mol | |
NO (g) | CO (g) | ||
甲 | T1 | 0.20 | 0.20 |
乙 | T1 | 0.30 | 0.30 |
丙 | T2 | 0.20 | 0.20 |
下列说法正确的是
A. 该反应的正反应为吸热反应
B. 达到平衡时,乙中CO2的体积分数比甲中的小
C. T1℃时,若起始时向甲中充入0.40 mol NO、0.40mol CO、0.40mol N2和0.40mol CO2,则反应达到新平衡前v(正)>v(逆)
D. T2℃时,若起始时向丙中充入0.06mol N2和0.12 mol CO2,则达平衡时N2的转化率大于40%
参考答案:
【答案】CD
【解析】试题分析:A.2NO(g)+2CO(g)N2(g)+2CO2(g),先拐先平温度高,甲状态温度高于丙,T1>T2,此时甲平衡状态二氧化碳物质的量小,说明温度越高平衡逆向进行,逆反应为吸热反应,正反应为放热反应,故A错误;
B.乙中可以看做是甲起始量达到平衡状态,再加入0.1molNO和0.1molCO,相当于增大平衡压强,平衡正向进行,达到平衡时,乙中CO2的体积分数比甲中的大,故B错误;
C.甲状态下平衡时CO物质的量为0.10mol,结合三行计算计算平衡常数,
2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
起始量(mol/L) 0.1 0.1 0 0
变化量(mol/L) 0.05 0.05 0.025 0.05
平衡量(mol/L) 0.05 0.05 0.025 0.05
K=![]() =10,
=10,
T1℃时,若起始时向甲中充入0.40 mol NO、0.40mol CO、0.40mol N2和0.40mol CO2,Qc=![]() =2.5<K=10.则反应达到新平衡前v(正)>v(逆),故C正确;
=2.5<K=10.则反应达到新平衡前v(正)>v(逆),故C正确;
D.T2℃时,平衡状态CO物质的量为0.12mol,
2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
起始量(mol) 0.2 0.2 0 0
转化量(mol) 0 0 0.1 0.2
变化量(mol) 0.08 0.08 0.04 0.08
平衡量(mol) 0.12 0.12 0.04 0.08
2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
起始量(mol) 0 0 0.06 0.12
转化量 0.12 0.12 0 0
若起始时向丙中充入0.06mol N2和0.12 mol CO2,反应逆向进行得到平衡状态,和起始量为0.12molNO和0.12molCO达到的平衡相同,和起始量0.2molCO、NO相比,相当于减少了NO、CO0.08mol的CO、NO,压强减小平衡逆向进行,所以氮气转化率大于40%,故D正确;故选CD。
-
科目: 来源: 题型:
查看答案和解析>>【题目】在一定温度下,将一定质量的混合气体在密闭容器中发生反应aA(g) + bB(g)
 cC(g) + dD(g),达到平衡时测得B气体的浓度为0.6mol/l,恒温下将密闭容器的容积扩大一倍,重新达到平衡时,测得B气体的浓度为 0.4mol/l,下列叙述中正确的是( )
cC(g) + dD(g),达到平衡时测得B气体的浓度为0.6mol/l,恒温下将密闭容器的容积扩大一倍,重新达到平衡时,测得B气体的浓度为 0.4mol/l,下列叙述中正确的是( )A. a+b>c+d
B. 平衡向右移动
C. 重新达平衡时,A气体浓度增大
D. 重新达平衡时,B的体积分数减小
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列指定反应的离子方程式正确的是
A. 用食醋除去水垢:CO32-+2CH3COOH=2CH3COO- +CO2↑+H2O
B. 明矾净水原理:A13++3H2O=Al(OH)3↓+3H+
C. 高锰酸钾酸性溶液与草酸反应:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
D. AlCl3溶液中加入过量氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
-
科目: 来源: 题型:
查看答案和解析>>【题目】进行物质导电性实验测定时,按照图a、图b分别接通线路,下列叙述正确的是( )

A.NaCl是电解质,图a、图b灯泡均会发光
B.图a灯泡不会发光,NaCl固体中不含Na+、Cl﹣
C.NaCl溶液在通电后发生:NaCl═Na++Cl﹣
D.通电前图b溶液由大量H2O、Na+、Cl﹣ 构成 -
科目: 来源: 题型:
查看答案和解析>>【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 1 mol NaHSO4熔融或溶于水时电离出的离子总数均为3NA
B. 17 g H2O2含有0.5NA个非极性共价键
C. 在1L0.5mol/LH2SO4溶液中,含有的氧原子数为2NA
D. 标准状况下,22.4 L Cl2溶于水转移的电子数为NA
-
科目: 来源: 题型:
查看答案和解析>>【题目】用如图装置制取表中的四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂)。其中正确的是( )

选项
气体
a
b
c
d
A
CO2
盐酸
CaCO3
饱和Na2CO溶液
浓硫酸
B
Cl2
浓盐酸
MnO2
NaOH溶液
浓硫酸
C
NH3
饱和NH4Cl溶液
消石灰
H2O
固体NaOH
D
NO
稀硝酸
铜屑
H2O
浓硫酸
A. A B. B C. C D. D
-
科目: 来源: 题型:
查看答案和解析>>【题目】能源危机是当前一个全球性问题。请回答下列问题:
(1)下列做法有助于能源“开源节流”的是_____________(填字母)。
a.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
b.大力开采煤、石油和天然气以满足人们日益增长的能源需求
c.减少资源消耗,注重资源的重复使用、资源的循环再生
(2)甲烷是一种优良的气体燃料。已知1g 甲烷完全燃烧生成CO2和H2O(l)过程中,放出55.6kJ 热量,写出表示甲烷燃烧热的热化学方程式:____________________________。
(3)已知稀溶液中,含30g溶质的醋酸溶液与NaOH 溶液恰好完全反应时,放出28.55kJ热量。写出表示醋酸与NaOH 反应的中和热的热化学方程式:___________________。
(4)已知: CH4(g)+2O2(g) =CO2(g)+2H2O(l) △H=-890.3kJmol-1
N2(g)+O2(g) ==2NO(g) △H=+180kJmol-1
CH4 可用于脱硝,其热化学方程式为CH4(g)+4NO(g)==CO2(g)+2N2(g)+2 H2O(l) △H=__________。
(5)如下图是298 K时N2与H2反应过程中能量变化的曲线图,该反应的热化学方程式为:_____________________________。

(6)已知断裂下列化学键需要吸收的能量分别为: H-H a kJmol-1\、H-O b kJmol-1、O=O c kJmol-1,根据有关数据估算氢气与氧气的反应:2H2+O2=2H2O 该反应的△H=_________________。
相关试题

