【题目】探究Mg(OH)2的溶解平衡时,利用下表三种试剂进行试验,下列说法中不正确的是( )
编号 | ① | ② | ③ |
分散质 | Mg(OH)2 | HCl | NH4Cl |
备注 | 悬浊液 | 1mol/L | 1mol/L |
A.向①中滴入几滴酚酞试液后,溶液显红色说明Mg(OH)2是一种弱电解质
B.为了使Mg(OH)2悬浊液溶解得更快,加入过量的NH4Cl浓溶液并充分振荡,效果更好
C.①、③混合后发生反应:![]()
D.向①中加入②,H+与OH-反应生成H2O,使c(OH-)减小,Mg(OH)2溶解平衡向溶解方向移动
参考答案:
【答案】A
【解析】
A. 水溶液能完全电离的电解质是强电解质,水溶液中部分电离属于弱电解质;
B. Mg(OH)2沉淀电离出来的OH-与NH4Cl电离出来的NH4+结合生成弱电解质,使c(OH-)减小,即促进Mg(OH)2的溶解;
C. NH4+能结合Mg(OH)2电离出的OH-,生成弱电解质;
D. 根据Mg(OH)2沉淀的溶解平衡移动分析。
A. 向Mg(OH)2中滴入几滴酚酞试液后,溶液显红色,只能说明Mg(OH)2能电离,使溶液呈碱性,但不能判断是部分电离还是完全电离,A项错误,符合题意;
B. Mg(OH)2沉淀电离出来的OH-与NH4Cl电离出来的NH4+结合生成NH3H2O,使Mg(OH)2悬浊液溶解的更快,可加入过量的NH4Cl浓溶液,B项正确,不符合题意;
C. NH4+结合Mg(OH)2沉淀电离出来的OH-生成NH3H2O,所以①、③混合后发生反应:![]() ,C项正确,不符合题意;
,C项正确,不符合题意;
D. Mg(OH)2的悬浊液中存在沉淀的溶解平衡,因此向①中加入②,c(OH-)减小,Mg(OH)2溶解平衡正向移动,D项正确,不符合题意;
答案选A。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某同学在实验室进行1,2-二溴乙烷的消去反应,按下列步骤进行,请填空:

(1)按图连接好仪器装置并___。
(2)在试管a中加入2 mL 1,2-二溴乙烷和5 mL 10% NaOH的___溶液,再向试管中加入几片___。
(3)在试管b中加少量溴水。
(4)用水浴法加热试管里的混合物,持续加热一段时间后,把生成的气体通入溴水中,观察到的现象是____。
(5)①写出发生反应的化学方程式:__________。
②本实验中应注意的问题有______。
-
科目: 来源: 题型:
查看答案和解析>>【题目】高铁酸钾(K2FeO4)是一种比Cl2、O3、KMnO4氧化性更强的多功能水处理剂。工业上可先制得高铁酸钠[离子反应为Fe(OH)3+ClO-+OH-→
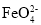 +Cl-+H2O]。然后在高铁酸钠溶液中加入一定量的KOH。可析出高铁酸钾。下列说法不正确的是( )
+Cl-+H2O]。然后在高铁酸钠溶液中加入一定量的KOH。可析出高铁酸钾。下列说法不正确的是( )A.高铁酸钾能除去水中溶解的H2S等
B.工业上制备高铁酸钠时每生成1mol还原产物,转移3mol电子
C.高铁酸钾中Fe为+6价,具有强氧化性,能杀菌消毒
D.高铁酸钾的还原产物易水解形成胶体,可使水中悬浮物凝聚沉降
-
科目: 来源: 题型:
查看答案和解析>>【题目】科学家合成出了一种新化合物(如图所示),其中M、W、T、L为同一短周期元素,L核外最外层电子数是W核外电子数的一半。下列叙述正确的是
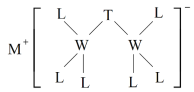
A.化合物ML属于离子化合物,也属于弱电解质
B.该新化合物中T满足8电子稳定结构
C.W的最高价氧化物可以与水反应生成弱酸
D.元素非金属性的顺序为W>T>L
-
科目: 来源: 题型:
查看答案和解析>>【题目】CuCl是应用广泛的有机合成催化剂,可从黄铜矿(主要成分为CuFeS2)中制取。
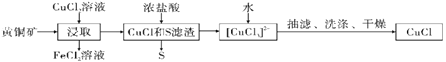
已知:CuCl是一种白色粉末,微溶于水,难溶于乙醇,在空气中易被氧化,在水溶液中存在平衡:CuCl(s)+2Cl-(aq)
 [CuCl3]2-(aq)(无色溶液),下列叙述错误的是( )
[CuCl3]2-(aq)(无色溶液),下列叙述错误的是( )A.浸取阶段,参加反应的CuFeS2和CuCl2的物质的量之比为3:l
B.浸取所得到的FeCl2溶液,可用来腐蚀覆在绝缘板上的铜箔制造印刷电路板
C.加水有利于CuCl(s)+2Cl-(aq)
 [CuCl3]2-(aq)平衡逆向移动,析出CuCl
[CuCl3]2-(aq)平衡逆向移动,析出CuClD.为提高产率和纯度,可采用乙醇洗涤、真空干燥
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图,甲是利用微生物将废水中的尿素[CO(NH2)2]的化学能直接转化为电能,并生成环境友好物质的装置,同时利用此装置的电能在铁上镀铜,下列说法中错误的是( )
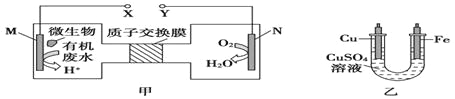
A.乙装置中溶液颜色不变
B.铜电极应与Y相连接
C.M电极反应式:CO(NH2)2+H2O-6e-=CO2↑+N2↑+6H+
D.当N电极消耗0.25mol气体时,铜电极质量减少16g
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列常见分子中的化学键判断正确的是( )
A.CN-与N2结构相似,[Fe(CN)6]3-中配位键和π键的个数之比为2∶1
B.CH3CH2CH2OH分子中极性键与非极性键数目之比为8∶1
C.
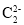 与
与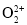 互为等电子体,1mol
互为等电子体,1mol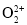 中含有的π键数目为2NA
中含有的π键数目为2NAD.已知反应N2O4(l)+2N2H4(l)=3N2(g)+4H2O(l),若该反应中有4molN—H键断裂,则形成的π键数目为6NA
相关试题

