【题目】分别放在0.1 molL-1H2SO4溶液中的四块相同的纯锌片,其连接情况如图所示:

(1)其腐蚀速率由快到慢的顺序是________;
(2)写出②号内正极发生的电极反应式_________;
(3)若③号烧杯内的电解质溶液为NaCl溶液,则Zn电极发生的电极反应式为______。
参考答案:
【答案】④>③>①>② 2H++2e-=H2↑ Zn-2e-+2OH-=Zn(OH)2
【解析】
(1)电化学腐蚀较化学腐蚀快,作原电池负极和电解池阳极的金属加速被腐蚀,作原电池正极和电解池阴极的金属被保护,金属腐蚀快慢顺序是:电解池阳极>原电池负极>化学腐蚀>原电池正极>电解池阳极;
(2)②中镁失去电子发生氧化反应,氢离子在正极上得电子发生还原反应生成氢气;
(3)③号烧杯内的电解质溶液为NaCl溶液,放置于空气中较长时间后发生吸氧腐蚀。
(1)金属腐蚀快慢顺序是:电解池阳极>原电池负极>化学腐蚀>原电池正极>电解池阳极。①中锌发生化学腐蚀;②中锌作正极加速被保护;③中锌作负极加速被腐蚀;④中锌作负极加速被腐蚀,由于金属活动性Sn>Pt,所以④中电势差比③大,Zn腐蚀速率比③快,所以锌被腐蚀快慢顺序是④>③>①>②;
(2)②中由于Mg活动性比Zn强,Mg作原电池的负极,失去电子发生氧化反应,Zn作正极,在正极Zn上,溶液中的H+得电子发生还原反应生成H2,正极的电极反应式为:2H++2e-=H2↑;
(3)③号烧杯内的电解质溶液为NaCl溶液,放置于空气中较长时间后发生吸氧腐蚀,锌作负极,失去电子,发生氧化反应变为Zn2+,再与溶液中产生的OH-结合形成Zn(OH)2,Zn电极的反应式为:Zn-2e-+2OH-=Zn(OH)2,锡作正极发生还原反应,电极反应式为,O2+2H2O+4e-=4OH-。
-
科目: 来源: 题型:
查看答案和解析>>【题目】设NA为阿伏加德罗常数值。如图表示N2O在Pt2O+表面与CO反应转化成无害气体的过程。下列说法正确的是
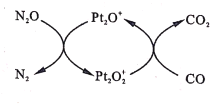
A.N2O转化成无害气体时的催化剂是Pt2O2+
B.每1mol Pt2O+转化为Pt2O2+得电子数为3NA
C.将生成的CO2通人含大量SiO32-、Na+、Cl-的溶液中,无明显现象
D.1g CO2 、N2O的混合气体中含有电子数为0.5NA
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列离子方程式的书写及评价,均合理的是
选项
离子方程式
评价
A
用铜电极电解饱和KCl溶液:2H2O+2Cl-
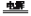 H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-正确:Cl-的失电子能力比OH-强
B
向CuSO4溶液中通入过量的H2S气体:Cu2++H2S=CuS↓+2H+
错误:H2S的酸性比H2SO4弱
C
Ba(HCO3)2溶液与足量的NaOH溶液反应:Ba2++HCO3- +OH- ═BaCO3↓+H2O
错误:Ba2+与HCO3-系数比应为1:2
D
过量SO2通入到NaClO溶液中:SO2+ClO- +H2O= HClO+HSO3-
正确:H2SO3的酸性比HClO强
A.AB.BC.CD.D
-
科目: 来源: 题型:
查看答案和解析>>【题目】在容积为2L的密闭容器中进行如下反应:A(g)+2B(g)
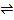 3C(g)+nD(g),开始时A为4mol,B为6mol;5min末时测得C的物质的量为3mol,用D表示的化学反应速率v(D)为0.2mol/(L·min)。计算:
3C(g)+nD(g),开始时A为4mol,B为6mol;5min末时测得C的物质的量为3mol,用D表示的化学反应速率v(D)为0.2mol/(L·min)。计算:(1)5min末A的物质的量浓度为________。
(2)前5min内用B表示的化学反应速率v(B)为________。
(3)化学方程式中n值为________。
(4)此反应在四种不同情况下的反应速率分别为:
①v(A)=5mol/(L·min)
②v(B)=6mol/(L·min)
③v(C)=4.5mol/(L·min)
④v(D)=8mol/(L·min)
其中反应速率最快的是________(填编号)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】常见的五种盐X、Y、Z、M、N,它们的阴离子可能是SO42-、Cl-、NO3-、CO32-,阳离子可能是Ag+、NH4+、Na+、Al3+、Cu2+、Ba2+、Fe3+,已知:①M的焰色反应呈黄色。②五种盐均能溶于水,水溶液均为无色。③X的溶液呈中性,Y、Z、N的溶液呈酸性,M的溶液呈碱性。④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有X、Z的溶液不产生沉淀。⑤若在这五种盐的溶液中,分别加入氨水,N和Z的溶液中生成沉淀,继续加氨水,Z中沉淀消失。⑥把X的溶液分别加入到Y、Z、N的溶液中,均能生成不溶于稀硝酸的沉淀。请回答下列问题:
(1)五种盐中,所含阴离子相同的两种盐的化学式是______________。
(2)M溶液显碱性的原因是(用离子方程式表示)_______________________。
(3)X和Z的溶液反应的离子方程式是______________________________。
(4)N和氨水反应的离子方程式是_____________________________________。
(5)若要检验Y中所含的阳离子,正确的实验方法是_________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某有机物A的分子式为C4H8O2,已知A~E有下列转化关系如下,试回答下列问题:

(1)C中的官能团名称是_______;
(2)E的结构简式是_______。
(3)在图中①~④的反应中,属于氧化反应的有________。
(4)写出反应②的化学方程式_______。
-
科目: 来源: 题型:
查看答案和解析>>【题目】(1)已知食盐常加入KIO3 来补充碘元素,检验食盐中是否加碘,可利用如下反应:__KIO3+___KI+___H2SO4═___K2SO4+___I2+___H2O(配平反应方程式)。
①利用上述反应检验食盐中是否加碘,所需试剂是________(填下列选项的序号)
A、碘水B、KI溶液C、淀粉溶液D、稀硫酸E、AgNO3溶液
②如果反应中转移0.2mol电子,则生成I2的物质的量为___________
(2)Cl2是一种有毒气体,如果泄漏会造成严重的环境污染。化工厂可用浓氨水来检验Cl2是否泄漏,有关反应的化学方程式为:3Cl2(气)+8NH3(气)=6NH4Cl(固)+N2(气)若反应中消耗Cl2 1.5mol,则被氧化的NH3在标准状况下的体积为___L。
相关试题

