【题目】下列离子方程式的书写及评价,均合理的是
选项 | 离子方程式 | 评价 |
A | 用铜电极电解饱和KCl溶液:2H2O+2Cl- | 正确:Cl-的失电子能力比OH-强 |
B | 向CuSO4溶液中通入过量的H2S气体:Cu2++H2S=CuS↓+2H+ | 错误:H2S的酸性比H2SO4弱 |
C | Ba(HCO3)2溶液与足量的NaOH溶液反应:Ba2++HCO3- +OH- ═BaCO3↓+H2O | 错误:Ba2+与HCO3-系数比应为1:2 |
D | 过量SO2通入到NaClO溶液中:SO2+ClO- +H2O= HClO+HSO3- | 正确:H2SO3的酸性比HClO强 |
A.AB.BC.CD.D
参考答案:
【答案】C
【解析】
A项、用铜电极电解饱和KCl溶液时,阳极是铜电极放电,溶液中Cl-不能放电生成氯气,故A错误;
B项、CuSO4溶液能与过量的H2S气体反应能够发生的原因是生成的硫化铜沉淀不能溶于硫酸,与酸性强弱无关,故B错误;
C项、Ba(HCO3)2溶液与足量的NaOH溶液反应,不足量的Ba(HCO3)2溶液完全反应,反应消耗的Ba2+与HCO3-的物质的量比为1:2,故离子方程式书写错误,故C正确;
D项、SO2具有还原性,NaClO具有强氧化性,过量SO2通入到NaClO溶液中发生氧化还原反应,不是复分解反应,与酸性强弱无关,故D错误;
故选C。
-
科目: 来源: 题型:
查看答案和解析>>【题目】碳及其化合物的用途广泛,碳元素不仅能形成丰富多彩的有机化合物,而且还能形成多种无机化合物,同时自身可以形成多种单质。
(1)C60分子形成的晶体中,在晶胞的顶点和面心均含有一个C60分子,则一个C60晶胞的质量为____。
(2)干冰和冰是两种常见的分子晶体,下列关于两种晶体的比较中正确的是____。
a. 晶体的密度:干冰>冰 b. 晶体的熔点:干冰>冰
c. 晶体中的空间利用率:干冰>冰 d. 晶体中分子间相互作用力类型相同
(3)金刚石和石墨是碳元素形成的两种常见单质,下列关于这两种单质的叙述中正确的有____。
a. 金刚石中碳原子的杂化类型为sp3杂化,石墨中碳原子的杂化类型为sp2杂化
b. 晶体中共价键的键长:金刚石中C-C<石墨中C-C
c. 晶体的熔点:金刚石>石墨
d. 晶体中共价键的键角:金刚石>石墨
e. 金刚石晶体中只存在共价键,石墨晶体中则存在共价键、金属键和范德华力
f. 金刚石和石墨的熔点都很高,所以金刚石和石墨都是原子晶体
(4)金刚石晶胞结构如图所示,立方BN结构与金刚石相似,在BN晶体中,B原子周围最近的N原子所构成的立体图形为____,一个晶胞中N原子数目为____。
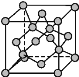
(5)碳与孔雀石共热可以得到金属铜,金属铜采用面心立方最密堆积,即在晶胞的顶点和面心均含有一个Cu原子,则Cu晶体中Cu原子的配位数为___。已知Cu晶体的密度为ρ g·cm-3,Cu的相对原子质量为M,阿伏加德罗常数为NA,则Cu的原子半径为____。
-
科目: 来源: 题型:
查看答案和解析>>【题目】Ⅰ.CO2催化加氢制甲醇是极具前景的资源化研究领域,主要反应有:
i.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH1=-49.4kJ·mol-1
CH3OH(g)+H2O(g) ΔH1=-49.4kJ·mol-1ii.CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH2=+41.2kJ·mol-1
CO(g)+H2O(g) ΔH2=+41.2kJ·mol-1iii.CO(g)+2H2(g)
 CH3OH(g) ΔH3
CH3OH(g) ΔH3(1)ΔH3=___kJ·mol-1。
(2)已知反应i的速率方程为v正=k正x(CO2)·x3(H2),v逆=k逆·x(CH3OH)·x(H2O),k正、k逆均为速率常数且只与温度有关,x为物质的量分数。其物质的量分数平衡常数Kx=___(以k正、k逆表示)。
(3)5MPa时,往某密闭容器中按投料比n(H2):n(CO2)=3:1充入H2和CO2。反应达平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。
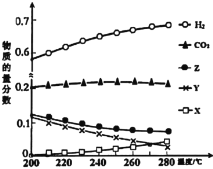
①图中Y代表___(填化学式)。
②250℃时反应ii的Kx___1(填“>”、“<”或“=”)
③下列措施中,一定无法提高甲醇产率的是___。
A.加入适量CO B.使用催化剂
C.循环利用原料气 D.升高温度
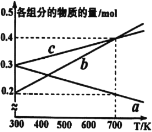
(4)在10MPa下将H2、CO按一定比例投料,平衡状态时各组分的物质的量与温度的关系如图所示。曲线b代表的物质为____(填化学式)。温度为700K时,该反应的平衡常数KP=___(MPa)-2(结果用分数表示)。
Ⅱ.在恒容容器中,使用某种催化剂对反应NO2(g)+SO2(g)
 SO3(g)+NO(g) ΔH<0
SO3(g)+NO(g) ΔH<0进行相关实验探究。改变投料比[n(SO2):n(NO2)]进行多组实验(各次实验的温度可能相同,也可能不同),测定SO2的平衡转化率[α(SO2)]实验结果如图所示。
已知:KR=16,KZ=
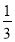 。
。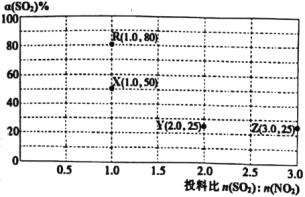
(5)如果要将图中R点的平衡状态改变为X点的平衡状态。应采取的措施是___。
(6)通过计算确定图中R、X、Y、Z四点中温度相等的点是__。
-
科目: 来源: 题型:
查看答案和解析>>【题目】设NA为阿伏加德罗常数值。如图表示N2O在Pt2O+表面与CO反应转化成无害气体的过程。下列说法正确的是
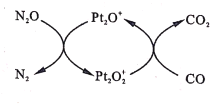
A.N2O转化成无害气体时的催化剂是Pt2O2+
B.每1mol Pt2O+转化为Pt2O2+得电子数为3NA
C.将生成的CO2通人含大量SiO32-、Na+、Cl-的溶液中,无明显现象
D.1g CO2 、N2O的混合气体中含有电子数为0.5NA
-
科目: 来源: 题型:
查看答案和解析>>【题目】在容积为2L的密闭容器中进行如下反应:A(g)+2B(g)
 3C(g)+nD(g),开始时A为4mol,B为6mol;5min末时测得C的物质的量为3mol,用D表示的化学反应速率v(D)为0.2mol/(L·min)。计算:
3C(g)+nD(g),开始时A为4mol,B为6mol;5min末时测得C的物质的量为3mol,用D表示的化学反应速率v(D)为0.2mol/(L·min)。计算:(1)5min末A的物质的量浓度为________。
(2)前5min内用B表示的化学反应速率v(B)为________。
(3)化学方程式中n值为________。
(4)此反应在四种不同情况下的反应速率分别为:
①v(A)=5mol/(L·min)
②v(B)=6mol/(L·min)
③v(C)=4.5mol/(L·min)
④v(D)=8mol/(L·min)
其中反应速率最快的是________(填编号)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】分别放在0.1 molL-1H2SO4溶液中的四块相同的纯锌片,其连接情况如图所示:

(1)其腐蚀速率由快到慢的顺序是________;
(2)写出②号内正极发生的电极反应式_________;
(3)若③号烧杯内的电解质溶液为NaCl溶液,则Zn电极发生的电极反应式为______。
-
科目: 来源: 题型:
查看答案和解析>>【题目】常见的五种盐X、Y、Z、M、N,它们的阴离子可能是SO42-、Cl-、NO3-、CO32-,阳离子可能是Ag+、NH4+、Na+、Al3+、Cu2+、Ba2+、Fe3+,已知:①M的焰色反应呈黄色。②五种盐均能溶于水,水溶液均为无色。③X的溶液呈中性,Y、Z、N的溶液呈酸性,M的溶液呈碱性。④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有X、Z的溶液不产生沉淀。⑤若在这五种盐的溶液中,分别加入氨水,N和Z的溶液中生成沉淀,继续加氨水,Z中沉淀消失。⑥把X的溶液分别加入到Y、Z、N的溶液中,均能生成不溶于稀硝酸的沉淀。请回答下列问题:
(1)五种盐中,所含阴离子相同的两种盐的化学式是______________。
(2)M溶液显碱性的原因是(用离子方程式表示)_______________________。
(3)X和Z的溶液反应的离子方程式是______________________________。
(4)N和氨水反应的离子方程式是_____________________________________。
(5)若要检验Y中所含的阳离子,正确的实验方法是_________________________。
相关试题

