【题目】碳的氧化物和氮的氧化物与人类生活息息相关,它们之间有多种相互转化关系,可以变废为宝。
(1)为了模拟汽车尾气在催化转化器内的工作反应情况,控制定条件,让反应在恒容密闭容器中进行如下反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g),用传感器测得不同时间NO和CO的依度如下表:
N2(g)+2CO2(g),用传感器测得不同时间NO和CO的依度如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)(10-4mol/L) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(NO)(10-3mol/L) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
①前2s内的平均反应速率v(N2)=________,此温度下,该反应的平衡常数K=_______
②能说明上述反应达到平衡状态的是____________。
A.2n(CO2)=n(N2) B.混合气体的平均相对分子质量不变
C.气体密度不变 D.容器内气体压强不变
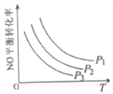
③当NO与CO浓度相等时,体系中NO的平衡转化率与温度、压强的关系如图所示。则NO的平衡转化率随温度升高而减小的原因是___,压强P1、P2、P3的大小关系是____________,理由是_______________________。
(2)用氨气催化氧化还原法脱硝(NOx)
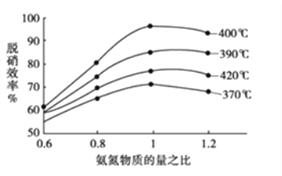
①根据下图判断提高脱硝效率(单位时间内NOx浓度变化占烟气初始浓度的百分比)的最佳条件是:______________________。
②已知:N2(g)+O2(g)=2NO(g) △H=+akJ/mol
N2(g)+3H2(g)![]() 2NH3(g) △H=-bk/mol
2NH3(g) △H=-bk/mol
2H2(g)+O2(g)=2H2O(g) △H=-ckJ/mol 其中a、b、C均为大于0。
则放热反应:4NO(g)+4NH3(g)+O2(g)![]() 4N2(g)+6H2O(g) △H=____________。
4N2(g)+6H2O(g) △H=____________。
参考答案:
【答案】 1.875×10-4mol·L-1·s-1 5000L/mol BD 该反应正反应放热,升高温度,平衡逆向移动,NO的平衡转化率减小 P1>P2>P3 正反应为体积减小的反应,增压平衡正向移动,NO的衡转化率增大 400℃、氨氮物质的量之比为1 -(2a-2b+3c)或2b-2a-3c kJ/mol
【解析】试题分析:(1)①前2s内NO的浓度变化是7.5×10-4mol·L-1,则N2的浓度变化是3.75×10-4mol·L-1,根据![]() 计算速率;根据表格数据,反应在4s时达到平衡状态,根据K=
计算速率;根据表格数据,反应在4s时达到平衡状态,根据K=![]() 计算 。②根据平衡标志分析;③NO的平衡转化率随温度升高而减小,说明升高温度平衡逆向移动,正反应放热;正反应为体积减小的反应,增压平衡正向移动;(2) ①根据图像,400℃、氨氮物质的量之比为1时,脱硝效率最高;②根据盖斯定律计算4NO(g)+4NH3(g)+O2(g)
计算 。②根据平衡标志分析;③NO的平衡转化率随温度升高而减小,说明升高温度平衡逆向移动,正反应放热;正反应为体积减小的反应,增压平衡正向移动;(2) ①根据图像,400℃、氨氮物质的量之比为1时,脱硝效率最高;②根据盖斯定律计算4NO(g)+4NH3(g)+O2(g)![]() 4N2(g)+6H2O(g)的△H;
4N2(g)+6H2O(g)的△H;
解析:(1) ①前2s内NO的浓度变化是7.5×10-4mol·L-1,则N2的浓度变化是3.75×10-4mol·L-1, ![]() 1.875×10-4mol·L-1·s-1;
1.875×10-4mol·L-1·s-1;
根据表格数据,反应在4s时达到平衡状态

K=![]() 5000L/mol;
5000L/mol;
② 2n(CO2)=n(N2),都是指正反应方向,所以不一定平衡,故A错误;根据![]() ,混合气体的平均相对分子质量是变量,所以混合气体的平均相对分子质量不变,一定达到平衡状态,故B正确;根据
,混合气体的平均相对分子质量是变量,所以混合气体的平均相对分子质量不变,一定达到平衡状态,故B正确;根据![]() ,气体密度是恒量,气体密度不变,不一定达到平衡状态,故C错误;反应前后气体物质的量是变量,压强是变量,所以容器内气体压强不变,一定达到平衡状态,故D正确。③正反应放热,升高温度平衡逆向移动,所以NO的平衡转化率随温度升高而减小;正反应为体积减小的反应,增压平衡正向移动,NO转化率越大,说明压强越大,所以压强P1>P2>P3;(2) ①根据图像,400℃、氨氮物质的量之比为1时,脱硝效率最高,所以脱硝的最佳条件是400℃、氨氮物质的量之比为1;② Ⅰ、N2(g)+O2(g)=2NO(g) △H=+akJ/mol
,气体密度是恒量,气体密度不变,不一定达到平衡状态,故C错误;反应前后气体物质的量是变量,压强是变量,所以容器内气体压强不变,一定达到平衡状态,故D正确。③正反应放热,升高温度平衡逆向移动,所以NO的平衡转化率随温度升高而减小;正反应为体积减小的反应,增压平衡正向移动,NO转化率越大,说明压强越大,所以压强P1>P2>P3;(2) ①根据图像,400℃、氨氮物质的量之比为1时,脱硝效率最高,所以脱硝的最佳条件是400℃、氨氮物质的量之比为1;② Ⅰ、N2(g)+O2(g)=2NO(g) △H=+akJ/mol
Ⅱ、N2(g)+3H2(g)![]() 2NH3(g) △H=-bk/mol
2NH3(g) △H=-bk/mol
Ⅲ、2H2(g)+O2(g)=2H2O(g) △H=-ckJ/mol
根据盖斯定律Ⅲ![]() Ⅰ
Ⅰ![]() Ⅱ
Ⅱ![]() 得4NO(g)+4NH3(g)+O2(g)
得4NO(g)+4NH3(g)+O2(g)![]() 4N2(g)+6H2O(g) △H=2b-2a-3c kJ/mol;
4N2(g)+6H2O(g) △H=2b-2a-3c kJ/mol;
-
科目: 来源: 题型:
查看答案和解析>>【题目】金晶体的最小重复单元(也称晶胞)是面心立方体,即在立方体的8个顶点各有一个金原子,各个面的中心有一个金原子,每个金原子被相邻的晶胞所共有(如图)。金原子的直径为d,用NA表示阿伏加德罗常数,M表示金的摩尔质量。

(1)金晶体每个晶胞中含有________个金原子。
(2)欲计算一个晶胞的体积,除假定金原子是刚性小球外,还应假定_______。
(3)一个晶胞的体积是多少?
(4)金晶体的密度是多少?
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列叙述正确的是( )
A.用苯萃取碘水中的碘,后分液,水层从上口倒出
B.金属氧化物都是碱性氧化物
C.三氯化铁溶液滴入氢氧化钠溶液可制备氢氧化铁胶体
D.可用量筒准确量取9.5mL水 -
科目: 来源: 题型:
查看答案和解析>>【题目】利用酸解法制钛白粉产生的废液[含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4]生产铁红和补血剂乳酸亚铁。其生产步骤如下:
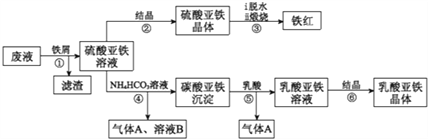
已知:TiOSO4可溶于水,在水中可以电离为TIO2+和SO42-,TiOSO4水解成TiO2·xH2O沉淀为可逆反应;乳酸结构简式为CH3CH(OHCOOH.请回答:
(1)步骤①中分离硫酸重铁溶液和滤渣的操作是______________。
(2)加入铁屑的目一是还原少量Fe2(SO4)3;二是使少量TiOSO4转化为TiO2·xH2O滤渣,用平衡移动的原理解释得到滤渣的原因_______________。
(3)硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为_____________。
(4)用离子方程式解释步骤⑤中加乳酸能得到乳酸亚铁的原因___________________。
(5)步骤④的离子方程式是________________。
(6)步骤⑥必须控制一定的真空度,原因是有利于蒸发水以及_______________。
(7)乳酸亚佚晶体{[CH3CH(OH)COO]2Fe·3H2O}纯度的测量:若用KMnO4滴定法测定样品中Fe的量进而计算纯度时,发现结果总是大于100%,其原因可能是_______________。
经查阅文献后,改用Ce(SO4)2标准溶液滴定进行测定。反应中Ce4+离子的还原产物为Ce3+。测定时,先称取5.760g样品,溶解后进行必要处理,用容量瓶配制成250mL溶液,每次取25.00mL,用0.1000mol/LCe(SO4)2标准溶液滴定至终点记录数据如下表。
滴定次数
0.1000mol/LCe(SO4)2标准溶液/mL
滴定前读数
滴定后读数
1
0.10
19.85
2
0.12
21.32
3
1.05
20.70
4
0.16
19.88
则产品中乳酸亚铁晶体的纯度为_______(以质量分数表示)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】由B、N及Mg、Ni等元素组成的新型材料有着广泛的用途,回答下列向题:
(1)Ni2+元素基态原子的电子排布式为____________。
(2)经测定发现,N2O5固体由NO2+和NO3-同种离子组成,该固体中N原子杂化类型为_____;与NO2+互为等电子体的微粒有______(写出一种)。
(3)铵盐大多不稳定。NH4F、NH4I中,较易分解的是______,原因是____________。
(4)第二周期中,第一电离能介于B元素和N元素间的元素为_______(填元素符号)
(5)已知NiO的晶体结构如图所示。
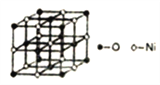
①NiO的晶体结构可描述为:氧原子位于面心和顶点,氧原子可形成正八面体空隙和正四面体空隙,镍原子填充在氧原子形成的空隙中。则NiO晶体中镍原子填充在氧原子形成的____体空隙中。
②已知MgO与NiO的晶体结构相同,其中Mg2+和Ni2+的离子半径分别为66pm和69pm,则熔点MgO______NiO(填“>”、“<”或“=”),理由是___________。
(6)硼和氮构成的一种氮化硼晶体的结构与石墨晶体结构相类似B、N原子相互交替排列如图左下图,其晶胞结构如右下图所示。设层内B-N核间距为apm,面间距为bpm,则该氮化硼晶体的密度为_______g/cm3(用含a、b、NA的代数式表示)。
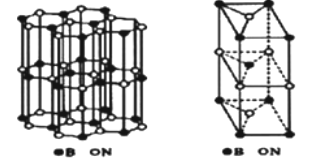
-
科目: 来源: 题型:
查看答案和解析>>【题目】无水氯化钙是一种价廉、优质的干燥剂,氯化钙属于
A. 酸 B. 碱 C. 盐 D. 混合物
-
科目: 来源: 题型:
查看答案和解析>>【题目】为了检验某含有NaHCO3杂质的Na2CO3样品的纯度,现将w1 g样品加热,其质量变为w2 g,则该样品中Na2CO3的纯度(质量分数)是
A.
 B.
B.  C.
C.  D.
D. 
相关试题

