【题目】下列化学用语表示正确的是( )
A.乙酸的结构简式:C2H4O2
B.乙烯的电子式: ![]()
C.硫离子结构示意图: ![]()
D.氢氧化钡的电离方程式:Ba(OH)2=Ba2++(OH﹣)2
参考答案:
【答案】C
【解析】解:A.乙酸结构简式为CH3COOH,C2H4O2为分子式,故A错误;
B.乙烯含有碳碳双键,电子式为 ![]() ,故B错误;
,故B错误;
C.硫离子核外有3个电子层,最外层电子数为8,硫离子结构示意图为 ![]() ,故C正确;
,故C正确;
D.Ba(OH)2电离出2个OH﹣,电离方程式为Ba(OH)2=Ba2++2OH﹣,故D错误.
故选C.
A.乙酸含有羧基,C2H4O2为分子式;
B.乙烯含有碳碳双键;
C.硫离子核外有3个电子层,最外层电子数为8;
D.Ba(OH)2电离出2个OH﹣.
-
科目: 来源: 题型:
查看答案和解析>>【题目】A、B、D、E、F五种元素的原子序数依次增大,除F为过渡元素外,其余四种均是短周期元素.已知:
①F的单质为生活中最常见的金属之一,原子最外层有2个电子;②E原子的价电子排布为msnmpn , B原
子的核外L层电子数为奇数;③A、D原子p轨道的电子数分别为2和4.请回答下列问题:
(1)F的稳定价态离子的电子排布式是;A、B、D、E四种元素的第一电离能由大到小的顺序为(用元素符号表示).
(2)对于B的简单氢化物,其中心原子的轨道杂化类型是 . 分子的立体构型为
, 该氢化物易溶于D的简单氢化物的主要原因是 .
(3)D原子分别与A、B原子形成的单键中,键的极性较强是(用具体的化学键表示).
(4)如图所示的晶胞是由AD两元素组成的,下列有关该晶体的说法中正确的是 .
a.该晶体的化学式为AD b.该晶体中A、D原子间形成的是双键
c.该晶体熔点可能比SiO2晶体高 d.该晶体可溶于水.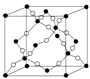
-
科目: 来源: 题型:
查看答案和解析>>【题目】研究小组用如图装置制取Cl2 , 证明产生的气体中含有HCl.
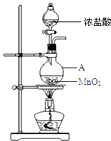
(1)仪器A的名称为;A中反应的离子方程式为;
(2)甲同学将A中产生的气体通入如表溶液:实验序号
试剂
现象
a
紫色石蕊溶液
b
AgNO3溶液
出现白色沉淀
①实验a中的现象为;
②不能证明产生的气体中含有HCl的实验是(填字母序号);
(3)已知将HCl气体通入饱和食盐水中有白色固体析出.乙同学将A中产生的气体通入饱和食盐水中,有白色固体析出,但该实验不能证明气体中含有HCl,结合化学用语解释其原因;
(4)已知:2S2O32﹣+I2═S4O62﹣+2I﹣ . 丙同学将A中产生的气体通入蒸馏水中,得到溶液X,进行以下实验证明气体中含有HCl.
I.测定X中溶解的Cl2 . 取25.00mL溶液X,加入过量KI溶液,然后用0.04molL﹣1 Na2S2O3溶液滴定生成
的I2 , 达滴定终点时消耗Na2S2O3溶液V mL.
Ⅱ.测定X中Cl元素总量.另取25.00mL溶液X,选用适当的还原剂将溶解的Cl2全部还原为Cl﹣ , 再用0.10molL﹣1 AgNO3溶液滴定所得溶液中的Cl﹣ .
①X中的HClO不会影响I的测定结果,原因是;
②由I、Ⅱ中实验数据可证明A中产生的气体中含有HCl,则Ⅱ中消耗0.10molL﹣1 AgNO3溶液的体积应大于mL(用含V的代数式表示). -
科目: 来源: 题型:
查看答案和解析>>【题目】在2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O反应中( )
A. 氧化剂与还原剂的物质的量之比为1∶8
B. 氧化剂与还原剂的物质的量之比为5∶1
C. 氧化产物与还原产物的物质的量之比为5∶2
D. 氧化产物与还原产物的物质的量之比为2∶5
-
科目: 来源: 题型:
查看答案和解析>>【题目】某课外兴趣小组探究利用废铜屑制取CuSO4溶液,设计了以下几种实验方案:
(1)方案一:以铜和浓硫酸反应制备硫酸铜溶液.方案二:将废铜屑在空气中灼烧后再投入稀硫酸.和方案一相比,方案二的优点是;
(2)方案二的实验中,发现容器底部残留少量紫红色固体,再加入稀硫酸依然不溶解,该固体为 .
(3)方案三的实验流程如图1所示:溶解过程中有气体放出,该气体是 . 随着反应的进行,生成气体速度加快,推测可能的原因 .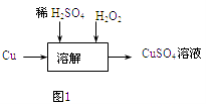
(4)设计实验证明你的推测 .
(5)方案四的实验流程如图2所示:为了得到较纯净的硫酸铜溶液,硫酸和硝酸的物质的量之比应为 .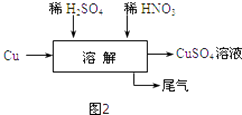
(6)对方案四进行补充完善,设计一个既能防止污染,又能实现物料循环的实验方案(用流程图表示). -
科目: 来源: 题型:
查看答案和解析>>【题目】下列物质的水溶液经加热浓缩,蒸干灼烧仍能得到原物质的是( )
A.FeCl3
B.Cu(NO3)2
C.Na2SO3
D.NaAlO2 -
科目: 来源: 题型:
查看答案和解析>>【题目】化学反应原理揭示了不同的物质在水溶液中有不同的行为。请按要求回答下列问题:(已知:H2SO3: Ka1=1.7×10-2,Ka2=6.0×10-8 ; NH3·H2O:Kb=1.8×10-5)
(1)将等物质的量的SO2与NH3溶于水充分反应,所得溶液呈_________性,该溶液中各离子浓度由大到小的顺序为:_____________________________________________,所得溶液中c(H+)- c(OH-)=___________________________(填写表达式)

(2)用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如右图所示(电极材料为石墨)。
① 图中a极要连接电源的(填“正”或“负”)________极;C口流出的物质是________。
②SO32-放电的电极反应式为______________________________。
相关试题

