【题目】铝是最重要的金属之一,铝及其化合物在生活中有广泛的用途。
(1)纳米铝粉可以作高效催化剂、导电膜层、高档金属颜料等。普通铝在空气中能稳定存在,而纳米铝粉在空气中能自燃,从影响反应速率的角度分析其原因是________。
(2)工业上可用铝与软锰矿(主要成分为MnO2)反应来治炼金属锰。
①该反应的化学方程式为_________________。
②MnO2加入酸化后的H2O2溶液中,MnO2溶解,同时产生无色无味的气体。该反应的离子方程式是_____________,该反应中还原剂是___________。
(3)煅烧硫酸铝铵晶体,发生的主要反应为:4[NH4Al(SO4)2·12H2O]![]() 2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O将产生的气体通过下图所示装置。
2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O将产生的气体通过下图所示装置。
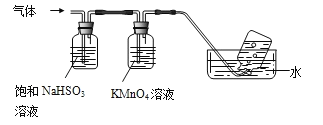
①集气瓶中收集到的气体是_________(填化学式)。
②B中酸性KMnO4溶液褪色(MnO4—还原为Mn2+),发生反应的离子方程式为__________。
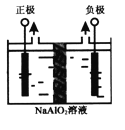
(4)Al(OH)3是重要化工原料。电解法制备高品质Al(OH)3的装置如图(中间用离子交换膜隔开),电解总反应方程式为4NaAlO2+10H2O![]() 4Al(OH)3↓+4NaOH+O2↑+2H2↑,阳极的电极反应式为____________。
4Al(OH)3↓+4NaOH+O2↑+2H2↑,阳极的电极反应式为____________。
参考答案:
【答案】纳米铝粉的表面积大,与氧气的接触更加充分 3MnO2+4Al![]() 3Mn+2A12O3 MnO2+H2O2+2H+=Mn2++O2↑+2H2O H2O2 N2 5SO2+2MnO4-+2H2O═5SO42-+2Mn2++4H+ 4AlO2-+6H2O-4e-=4Al(OH)3↓+O2↑
3Mn+2A12O3 MnO2+H2O2+2H+=Mn2++O2↑+2H2O H2O2 N2 5SO2+2MnO4-+2H2O═5SO42-+2Mn2++4H+ 4AlO2-+6H2O-4e-=4Al(OH)3↓+O2↑
【解析】
(1)纳米铝粉的表面积比普通铝大,与氧气的接触更加充分,所以纳米铝粉在空气中能自燃,故答案为:纳米铝粉的表面积大,与氧气的接触更加充分;
(2)①高温时,铝与二氧化锰发生铝热反应生成锰和氧化铝,反应的方程式为3MnO2+4Al![]() 3Mn+2A12O3,故答案为:3MnO2+4Al
3Mn+2A12O3,故答案为:3MnO2+4Al![]() 3Mn+2A12O3;
3Mn+2A12O3;
②由题意,MnO2加入酸化后的H2O2溶液中,MnO2溶解,同时产生无色无味的气体,说明Mn元素化合价降低被还原,MnO2做氧化剂被还原为Mn2+,氧元素化合价升高被氧化,H2O2做还原剂被氧化生成氧气,反应的化学方程式为MnO2+H2O2+2H+=Mn2++O2↑+2H2O,故答案为:MnO2+H2O2+2H+=Mn2++O2↑+2H2O;H2O2;
(3)①由装置图可知,NH4Al(SO4)2·12H2O煅烧分解生成的气体中,NH3和SO3被饱和亚硫酸钠吸收,二氧化硫被高锰酸钾吸收,所以最后集气瓶中收集到的气体是N2,故答案为:N2;
②SO2具有还原性,高锰酸钾具有氧化性,二者发生氧化还原反应生成SO42-和Mn2+离子,反应的方程式为5SO2+2MnO4-+2H2O═5SO42-+2Mn2++4H+,故答案为:5SO2+2MnO4-+2H2O═5SO42-+2Mn2++4H+;
(4)由电解总方程式可知,电解偏铝酸钠溶液制取氢氧化铝时,阳极上水电离出的氢氧根放电生成氧气,破坏水的电离平衡生成氢离子,氢离子与偏铝酸根及水生成氢氧化铝沉淀,电极反应式为4AlO2-+6H2O-4e-=4Al(OH)3↓+O2↑,故答案为:4AlO2-+6H2O-4e-=4Al(OH)3↓+O2↑。
-
科目: 来源: 题型:
查看答案和解析>>【题目】C、N和Si能形成多种高硬度材料,如SiN4、C3N4、SiC
(1)Si3N4和C3N4中硬度较高的是________,理由是_____________。
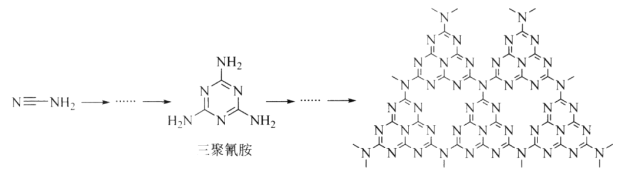
(2)C和N能形成一种类石墨结构材料,其合成过程如下图所示。该类石墨结构材料化合物的化学式为_______,其合成过程中有三聚氰胺形成,三聚氰胺中N原子的杂化方式有________。
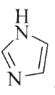
(3)C和N能形成一种五元环状有机物咪唑(简写为im),其结构为
 。化合物[Co(im)6]SiF6的结构示意图如下:
。化合物[Co(im)6]SiF6的结构示意图如下: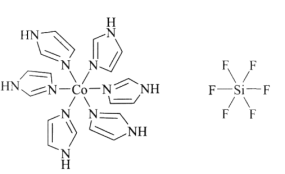
①阳离子[Co(im)6]2+和SiF62—之间除了阴阳离子间的静电作用力,还存在氢键作用写出该氢键的表示式:_______。(例如水中氢键的表示式为
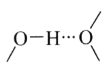 )
)②多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”,如SO2分子中存在“离域π键” π34,则im分子中存在的“离域π键”是______。
(4)
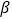 -SiC为立方晶系晶体,该晶胞中原子的坐标参数为
-SiC为立方晶系晶体,该晶胞中原子的坐标参数为C:(0,0,0);
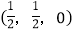 ;
;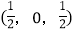 ;
;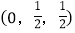 ;……
;……Si:
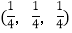 ;
;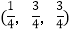 ;
;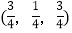 ;
;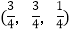
则
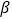 -SiC立方晶胞中含有_____个Si原子、________个C原子。
-SiC立方晶胞中含有_____个Si原子、________个C原子。 -
科目: 来源: 题型:
查看答案和解析>>【题目】下列关于苯乙烷(
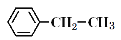 )的叙述,正确的是
)的叙述,正确的是①能使酸性高锰酸钾溶液褪色 ②可以发生加聚反应 ③可溶于水 ④可溶于苯 ⑤能与浓硝酸发生取代反应 ⑥所有原子可能共面
A. ①④⑤ B. ①②⑤⑥ C. ①②④⑤⑥ D. ①②③④⑤⑥
-
科目: 来源: 题型:
查看答案和解析>>【题目】根据下面的信息,下列叙述正确的是( )

A. 2molH2(g)跟1molO2(g)反应生成2molH2O(g)吸收能量为490kJ
B. 1molH2(g)跟0.5molO2(g)反应生成1molH2O(l)吸收能量为245kJ
C. 2molH2O(g)的能量比2molH2(g)与1molO2(g)的能量之和低
D. 化学反应中能量变化的大小与反应物的质量多少无关
-
科目: 来源: 题型:
查看答案和解析>>【题目】物质Ⅲ(2,3—二氢苯并呋喃)是一种重要的精细化工原料,其合成的部分流程如下:

下列叙述正确的是
A. 可用溴水可以鉴别化合物Ⅰ和Ⅱ
B. 物质Ⅰ在NaOH醇溶液中加热可发生消去反应
C. 物质Ⅱ中所有原子可能位于同一平面内
D. 物质Ⅲ与足量H2加成所得产物分子中有2个手性碳原子
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列类型的反应一定可以用来设计原电池的是
A.放热反应B.离子反应C.氧化还原反应D.复分解反应
-
科目: 来源: 题型:
查看答案和解析>>【题目】铜空气燃料电池容量高、成本低,具有广阔的发展前景。该电池通过一种复杂的“铜腐蚀现象”产生电能,其放电过程为2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法不正确的是( )

A. 放电时,Li+透过固体电解质向Cu极移动
B. 放电时,电子从锂电极通过负载流向铜电极
C. 放电时,锂电极为负极,发生氧化反应
D. 用该电池电解饱和食盐水,每产生1mol氯气(2Cl--2e-→Cl2)时,铜极质量改变64g
相关试题

