【题目】氮和碳的化合物与人类生产、生活密切相关。
(1)已知:N2(g)+O2(g)===2NO(g); ΔH=+180.5 kJ·mol-1
2H2(g)+O2(g)===2H2O(g); ΔH=-483.6 kJ·mol-1
则反应2H2(g)+2NO(g)===2H2O(g)+N2(g);ΔH=__________。
(2)在压强为0.1 MPa条件,将CO和H2的混合气体在催化剂作用下转化为甲醇的反应为CO(g)+2H2(g) ![]() CH3OH(g) ΔH<0
CH3OH(g) ΔH<0
①下列能说明该反应达到平衡状态的是________________。
a.混合气体的密度不再变化 b.CO和H2的物质的量之比不再变化
c.v(CO)=v(CH3OH) d.CO在混合气中的质量分数保持不变
②T1℃时,在一个体积为5 L的恒压容器中充入1 mol CO、2 mol H2,经过5 min达到平衡,CO的转化率为0.75,则T1℃时,CO(g)+2H2(g) ![]() CH3OH(g)的平衡常数K=_______________________。
CH3OH(g)的平衡常数K=_______________________。

③在T1℃时,在体积为5 L的恒容容器中充入一定量的H2和CO,反应达到平衡时CH3OH的体积分数与n(H2)/n(CO)的关系如图所示。温度不变,当![]() 时,达到平衡状态,CH3OH的体积分数可能是图象中的___________点。
时,达到平衡状态,CH3OH的体积分数可能是图象中的___________点。
(3)用催化转化装置净化汽车尾气,装置中涉及的反应之一为:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)

①探究上述反应中NO的平衡转化率与压强、温度的关系,得到如图1所示的曲线。催化装置比较适合的温度和压强是___________。
②测试某型号汽车在冷启动(冷启动指发动机水温低的情况下启动)时催化装置内CO和NO百分含量随时间变化曲线如图2所示。则前10 s内,CO和NO百分含量没明显变化的原因是____________。

(4)如图所示的装置能吸收和转化NO2和SO2。
①阳极区的电极反应式为___________________________。
②阴极排出的溶液中含S2O![]() 离子,能将NO2气体转化为无污染气体,同时生成的SO
离子,能将NO2气体转化为无污染气体,同时生成的SO![]() 可在阴极区再生。写出该反应的离子方程式:___________________________。
可在阴极区再生。写出该反应的离子方程式:___________________________。
参考答案:
【答案】 -664.1 kJ·mol-1 ad 75 F 400K,1Mpa 尚未达到催化剂工作温度或尚未达到反应所需的温度 SO2-2e-+2H2O===SO![]() +4H+ 4S2O
+4H+ 4S2O![]() +2 NO2+8OH-=8SO
+2 NO2+8OH-=8SO![]() +N2+4H2O
+N2+4H2O
【解析】(1)根据盖斯定律:第二个方程式减第一个方程式,整理后即可计算出该反应的ΔH= -664.1 kJ·mol-1;正确答案:-664.1 kJ·mol-1。
(2)①在压强不变的情况下,反应前后混合气体的总质量不发生改变,气体的总体积在发生变化,当二者的比值不再发生改变时,反应达到平衡状态,a正确;CO和H2都为反应物,在发生反应时是按照1:2比例进行的,无 论 进 行 到 什 么 程 度,二 者的物质的量之比不再变化,无法判断反应是否达平衡,b错误;v(CO)=v(CH3OH)没 有 标 出 速 率 的方向,无法判定,c错误;反应达到平衡状态后,CO在混合气中的质量分数保持不变,d正确。答案选ad。
② 因为CO的转化率为0.75,所 以 反应 中 消 耗 CO的 总 量为 0.75 mol,容器的体积为5 L。
CO(g) + 2H2(g) ![]() CH3OH(g)
CH3OH(g)
起始量 1 2 0
变化量 0.75 1.5 0.75
平衡量 0.25 0.5 0.75
平衡浓度0.05 0.1 0.15
平衡常数= 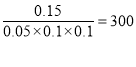 ,正确答案:300。
,正确答案:300。
③温度不变,当![]() 时, 甲醇的体积分数为最大值, 当
时, 甲醇的体积分数为最大值, 当![]() 时,虽然增加了氢气的浓度,平衡右移,甲醇的含量增加,但是混合气体的总体积增加的多,导致CH3OH的体积分数减少,应该是图象中的F点;正确选项F。
时,虽然增加了氢气的浓度,平衡右移,甲醇的含量增加,但是混合气体的总体积增加的多,导致CH3OH的体积分数减少,应该是图象中的F点;正确选项F。
(3)①根据图像可知,在压强不变的情况下,该反应温度越低,NO的转化率越大;当反应温度在400K时,压强为1 Mpa时,转化率为90%,当压强增大到5 Mpa时,转化率为95%,虽然转化率有提高,但是压强的增大,需 要 很 高 的 成本,不划算,所以催化装置比较适合的温度和压强是400K、1Mpa;答案为400K、1Mpa。
②需要控制在一定的温度范围内,才能发挥催化剂的最大催化能力,则前10 s内,尚未达到催化剂工作温度或尚未达到反应所需的温度,所以CO和NO百分含量没明显变化;正确答案:尚未达到催化剂工作温度或尚未达到反应所需的温度。
(4)①阳极发生氧化反应,SO2失去电子被氧化为硫酸,根据电子守恒、电荷守恒、原子守恒规律,极反应为SO2-2e-+2H2O===SO![]() +4H+ ;正确答案为 SO2-2e-+2H2O==SO
+4H+ ;正确答案为 SO2-2e-+2H2O==SO![]() +4H+。
+4H+。
②在碱性环境中,S2O![]() 离子中+3价硫元素被氧化为+4价的SO
离子中+3价硫元素被氧化为+4价的SO![]() ,NO2中+4价的氮元素被还原到0价,即为氮气,无污染气体,离子方程式为4S2O
,NO2中+4价的氮元素被还原到0价,即为氮气,无污染气体,离子方程式为4S2O![]() +2 NO2+8OH- = 8SO
+2 NO2+8OH- = 8SO![]() +N2
+N2
+4H2O ; 正确答案:4S2O![]() +2 NO2+8OH- =8SO
+2 NO2+8OH- =8SO![]() +N2+4H2O 。
+N2+4H2O 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】NaOH溶液滴定盐酸实验中,不必用到的是( )
A.酚酞
B.圆底烧杯
C.锥形瓶
D.碱式滴定管 -
科目: 来源: 题型:
查看答案和解析>>【题目】自然界的硫循环如下图所示,下列说法不正确的是

A. ①和②中硫元素均被氧化
B. ①是自然界形成酸雨的唯一原因
C. 含硫有机物和含硫无机物可相互转化
D. 控制化石燃料的使用可以减少SO2排放
-
科目: 来源: 题型:
查看答案和解析>>【题目】在一定条件下,某密闭容器中,可逆反应:N2 (g) +3H2(g)
 2NH3 (g)达到化学反应限度的标志是
2NH3 (g)达到化学反应限度的标志是A. 正、逆反应速率都等于零 B. N2、H2、NH3在容器中共存
C. N2、H2、NH3的浓度不再变化 D. N2、H2、NH3的分子数之比为1:3:2
-
科目: 来源: 题型:
查看答案和解析>>【题目】工业上利用硫铁矿烧渣(主要成分为Fe3O4、Fe2O3、FeO、SiO2)为原料制备高档颜料﹣﹣﹣﹣﹣铁红(Fe2O3),
具体生产流程如图: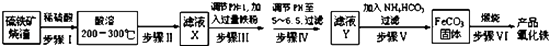
试回答下列问题:
(1)“酸溶”过程中Fe3O4发生反应的离子反应方程式为;
(2)实验室实现“步骤Ⅱ”中分离操作所用的玻璃仪器有、玻璃棒和烧杯等;步骤Ⅳ中应选用试剂调节溶液的pH(填字母编号)
A.稀硝酸 B.氢氧化钠溶液 C.高锰酸钾溶液 D.氨水
(3)检验步骤Ⅲ已经进行完全的试剂是;
(4)步骤Ⅴ的反应温度一般需控制在35℃以下,其目的是;
(5)步骤Ⅵ中发生反应的化学反应方程式为;
(6)步骤Ⅴ中,FeCO3达到沉淀溶解平衡时,若室温下测得溶液的pH为8.5,c(Fe2+)=1×10﹣6 molL﹣1 . 试判断所得的FeCO3中是否含有Fe(OH)2(填“是”或“否”),请通过简单计算说明理由(已知:Ksp[Fe(OH)2]=4.9×10﹣17). -
科目: 来源: 题型:
查看答案和解析>>【题目】下列微粒中,决定元素种类的是
A.质子数B.中子数C.质量数D.核外电子数
-
科目: 来源: 题型:
查看答案和解析>>【题目】海水中的氯化镁是镁的重要来源之一。下列从海水中提取镁涉及的化学方程式中,不正确的是
A. 制石灰乳:CaO + H2O === Ca(OH)2
B. 制氢氧化镁:MgCl2 + Ca(OH)2 === Mg(OH)2↓+ CaCl2
C. 制氯化镁:Mg(OH)2 +2HCl === MgCl2 + 2H2O
D. 制金属镁,在氯化镁溶液中加钠:2Na + MgCl2 === 2NaCl + Mg
相关试题

