【题目】海水中的氯化镁是镁的重要来源之一。下列从海水中提取镁涉及的化学方程式中,不正确的是
A. 制石灰乳:CaO + H2O === Ca(OH)2
B. 制氢氧化镁:MgCl2 + Ca(OH)2 === Mg(OH)2↓+ CaCl2
C. 制氯化镁:Mg(OH)2 +2HCl === MgCl2 + 2H2O
D. 制金属镁,在氯化镁溶液中加钠:2Na + MgCl2 === 2NaCl + Mg
参考答案:
【答案】D
【解析】分析:从海水中提取Mg的流程为: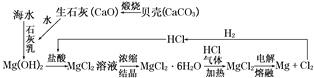 。A项,CaO与H2O化合成Ca(OH)2;B项,MgCl2与Ca(OH)2发生复分解反应生成Mg(OH)2和CaCl2;C项,Mg(OH)2与HCl发生中和反应生成MgCl2和H2O;D项,电解熔融MgCl2制Mg。
。A项,CaO与H2O化合成Ca(OH)2;B项,MgCl2与Ca(OH)2发生复分解反应生成Mg(OH)2和CaCl2;C项,Mg(OH)2与HCl发生中和反应生成MgCl2和H2O;D项,电解熔融MgCl2制Mg。
详解:从海水中提取Mg的流程为: 。A项,CaO与H2O化合成Ca(OH)2,反应的化学方程式为CaO+H2O=Ca(OH)2,A项正确;B项,向海水中加入石灰乳沉淀Mg2+,MgCl2与Ca(OH)2发生复分解反应生成Mg(OH)2和CaCl2,反应的化学方程式为MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2,B项正确;C项,用HCl溶解Mg(OH)2得MgCl2溶液,Mg(OH)2与HCl发生中和反应生成MgCl2和H2O,反应的化学方程式为Mg(OH)2+2HCl=MgCl2+2H2O,C项正确;D项,电解熔融MgCl2制Mg,Na加入MgCl2溶液中反应生成Mg(OH)2、NaCl和H2,反应的化学方程式为2Na+MgCl2+2H2O=Mg(OH)2↓+2NaCl+H2↑,D项错误;答案选D。
。A项,CaO与H2O化合成Ca(OH)2,反应的化学方程式为CaO+H2O=Ca(OH)2,A项正确;B项,向海水中加入石灰乳沉淀Mg2+,MgCl2与Ca(OH)2发生复分解反应生成Mg(OH)2和CaCl2,反应的化学方程式为MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2,B项正确;C项,用HCl溶解Mg(OH)2得MgCl2溶液,Mg(OH)2与HCl发生中和反应生成MgCl2和H2O,反应的化学方程式为Mg(OH)2+2HCl=MgCl2+2H2O,C项正确;D项,电解熔融MgCl2制Mg,Na加入MgCl2溶液中反应生成Mg(OH)2、NaCl和H2,反应的化学方程式为2Na+MgCl2+2H2O=Mg(OH)2↓+2NaCl+H2↑,D项错误;答案选D。
-
科目: 来源: 题型:
查看答案和解析>>【题目】氮和碳的化合物与人类生产、生活密切相关。
(1)已知:N2(g)+O2(g)===2NO(g); ΔH=+180.5 kJ·mol-1
2H2(g)+O2(g)===2H2O(g); ΔH=-483.6 kJ·mol-1
则反应2H2(g)+2NO(g)===2H2O(g)+N2(g);ΔH=__________。
(2)在压强为0.1 MPa条件,将CO和H2的混合气体在催化剂作用下转化为甲醇的反应为CO(g)+2H2(g)
 CH3OH(g) ΔH<0
CH3OH(g) ΔH<0①下列能说明该反应达到平衡状态的是________________。
a.混合气体的密度不再变化 b.CO和H2的物质的量之比不再变化
c.v(CO)=v(CH3OH) d.CO在混合气中的质量分数保持不变
②T1℃时,在一个体积为5 L的恒压容器中充入1 mol CO、2 mol H2,经过5 min达到平衡,CO的转化率为0.75,则T1℃时,CO(g)+2H2(g)
 CH3OH(g)的平衡常数K=_______________________。
CH3OH(g)的平衡常数K=_______________________。
③在T1℃时,在体积为5 L的恒容容器中充入一定量的H2和CO,反应达到平衡时CH3OH的体积分数与n(H2)/n(CO)的关系如图所示。温度不变,当
 时,达到平衡状态,CH3OH的体积分数可能是图象中的___________点。
时,达到平衡状态,CH3OH的体积分数可能是图象中的___________点。(3)用催化转化装置净化汽车尾气,装置中涉及的反应之一为:2NO(g)+2CO(g)
 N2(g)+2CO2(g)
N2(g)+2CO2(g)
①探究上述反应中NO的平衡转化率与压强、温度的关系,得到如图1所示的曲线。催化装置比较适合的温度和压强是___________。
②测试某型号汽车在冷启动(冷启动指发动机水温低的情况下启动)时催化装置内CO和NO百分含量随时间变化曲线如图2所示。则前10 s内,CO和NO百分含量没明显变化的原因是____________。

(4)如图所示的装置能吸收和转化NO2和SO2。
①阳极区的电极反应式为___________________________。
②阴极排出的溶液中含S2O
 离子,能将NO2气体转化为无污染气体,同时生成的SO
离子,能将NO2气体转化为无污染气体,同时生成的SO 可在阴极区再生。写出该反应的离子方程式:___________________________。
可在阴极区再生。写出该反应的离子方程式:___________________________。 -
科目: 来源: 题型:
查看答案和解析>>【题目】工业上利用硫铁矿烧渣(主要成分为Fe3O4、Fe2O3、FeO、SiO2)为原料制备高档颜料﹣﹣﹣﹣﹣铁红(Fe2O3),
具体生产流程如图: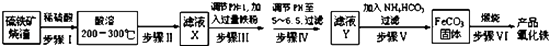
试回答下列问题:
(1)“酸溶”过程中Fe3O4发生反应的离子反应方程式为;
(2)实验室实现“步骤Ⅱ”中分离操作所用的玻璃仪器有、玻璃棒和烧杯等;步骤Ⅳ中应选用试剂调节溶液的pH(填字母编号)
A.稀硝酸 B.氢氧化钠溶液 C.高锰酸钾溶液 D.氨水
(3)检验步骤Ⅲ已经进行完全的试剂是;
(4)步骤Ⅴ的反应温度一般需控制在35℃以下,其目的是;
(5)步骤Ⅵ中发生反应的化学反应方程式为;
(6)步骤Ⅴ中,FeCO3达到沉淀溶解平衡时,若室温下测得溶液的pH为8.5,c(Fe2+)=1×10﹣6 molL﹣1 . 试判断所得的FeCO3中是否含有Fe(OH)2(填“是”或“否”),请通过简单计算说明理由(已知:Ksp[Fe(OH)2]=4.9×10﹣17). -
科目: 来源: 题型:
查看答案和解析>>【题目】下列微粒中,决定元素种类的是
A.质子数B.中子数C.质量数D.核外电子数
-
科目: 来源: 题型:
查看答案和解析>>【题目】以粉煤灰(主要成分为Al2O3和SiO2,还含有少量的FeO、Fe2O3等)为原料制备Al2O3的流程如下:
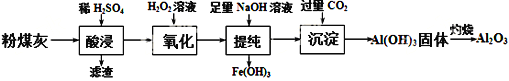
(1) “酸浸”时需加入过量的稀硫酸,写出Al2O3溶解的离子方程式___________________。
(2)证明酸浸后溶液中存在Fe3+的方法是:取酸浸后的溶液少许置于试管中,向其中滴加硫氰化钾溶液,溶液变为血红色;再慢慢滴入过量的H2O2溶液,溶液的红色先变深,之后红色逐渐褪去,继续滴加会有气泡逸出,该气体会使带火星的木条复燃。
①红色变深的原因是(用离子方程式表示):_____________________________;
②溶液红色褪去是由于过氧化氢氧化了硫氰根离子,已知双氧水氧化SCN—生成N2、CO2和SO42-,写出该反应的离子方程式:____________________________;
③有气体逸出,说明Fe3+对H2O2的分解有催化作用,写出催化过程第一步反应的离子方程式________________________________。

(3) “提纯”过程中,当加入NaOH溶液达到沉淀量最大时,溶液中c(SO42-)∶c(Na+)=___________。将H2S和空气的混合气体通入FeCl3 、FeCl2 、CuCl2的混合溶液中反应回收S,其物质转化如图所示。反应中当有1molH2S转化为硫单质时,保持溶液中Fe3+的物质的量不变,需要消耗O2的物质的量为______________。
(4) “沉淀”过程中,通入过量CO2时发生反应的化学方程式为________________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】A、B、D、E、F五种元素的原子序数依次增大,除F为过渡元素外,其余四种均是短周期元素.已知:
①F的单质为生活中最常见的金属之一,原子最外层有2个电子;②E原子的价电子排布为msnmpn , B原
子的核外L层电子数为奇数;③A、D原子p轨道的电子数分别为2和4.请回答下列问题:
(1)F的稳定价态离子的电子排布式是;A、B、D、E四种元素的第一电离能由大到小的顺序为(用元素符号表示).
(2)对于B的简单氢化物,其中心原子的轨道杂化类型是 . 分子的立体构型为
, 该氢化物易溶于D的简单氢化物的主要原因是 .
(3)D原子分别与A、B原子形成的单键中,键的极性较强是(用具体的化学键表示).
(4)如图所示的晶胞是由AD两元素组成的,下列有关该晶体的说法中正确的是 .
a.该晶体的化学式为AD b.该晶体中A、D原子间形成的是双键
c.该晶体熔点可能比SiO2晶体高 d.该晶体可溶于水.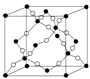
-
科目: 来源: 题型:
查看答案和解析>>【题目】研究小组用如图装置制取Cl2 , 证明产生的气体中含有HCl.
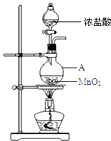
(1)仪器A的名称为;A中反应的离子方程式为;
(2)甲同学将A中产生的气体通入如表溶液:实验序号
试剂
现象
a
紫色石蕊溶液
b
AgNO3溶液
出现白色沉淀
①实验a中的现象为;
②不能证明产生的气体中含有HCl的实验是(填字母序号);
(3)已知将HCl气体通入饱和食盐水中有白色固体析出.乙同学将A中产生的气体通入饱和食盐水中,有白色固体析出,但该实验不能证明气体中含有HCl,结合化学用语解释其原因;
(4)已知:2S2O32﹣+I2═S4O62﹣+2I﹣ . 丙同学将A中产生的气体通入蒸馏水中,得到溶液X,进行以下实验证明气体中含有HCl.
I.测定X中溶解的Cl2 . 取25.00mL溶液X,加入过量KI溶液,然后用0.04molL﹣1 Na2S2O3溶液滴定生成
的I2 , 达滴定终点时消耗Na2S2O3溶液V mL.
Ⅱ.测定X中Cl元素总量.另取25.00mL溶液X,选用适当的还原剂将溶解的Cl2全部还原为Cl﹣ , 再用0.10molL﹣1 AgNO3溶液滴定所得溶液中的Cl﹣ .
①X中的HClO不会影响I的测定结果,原因是;
②由I、Ⅱ中实验数据可证明A中产生的气体中含有HCl,则Ⅱ中消耗0.10molL﹣1 AgNO3溶液的体积应大于mL(用含V的代数式表示).
相关试题

