【题目】一定温度下,水溶液中H+和OH﹣的浓度变化曲线如图,下列说法正确的是( ) 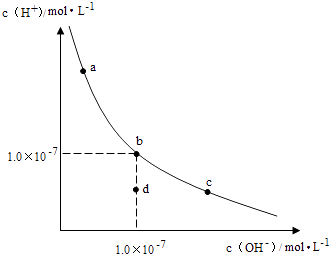
A.升高温度,可能引起由c向b的变化
B.该温度下,水的离子积常数为1.0×10﹣13
C.该温度下,加入FeCl3可能引起由b向a的变化
D.该温度下,稀释溶液可能引起由c向d的变化
参考答案:
【答案】C
【解析】解:A、由图可知abc三点对应的平衡常数不变,故abc为等温线,故升高温度,不能由c到b,故A错误;
B、b点c(H+)=c(OH﹣)=1.0×10﹣7 , 故KW=1.0×10﹣7×1.0×10﹣7=1.0×10﹣14 , 故B错误;
C、加入FeCl3 , 氯化铁为强酸弱碱盐,铁离子结合水电离出的氢氧根,促进水的电离平衡右移,即氢离子浓度增大,氢氧根离子浓度减小(由b到a),符合图象变化趋势,故C正确;
D、由c点到d点,水的离子积常数减小,温度不变,K不变,故不能利用稀释使其形成此变化,故D错误,
故选C.
【考点精析】根据题目的已知条件,利用弱电解质在水溶液中的电离平衡的相关知识可以得到问题的答案,需要掌握当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理.
-
科目: 来源: 题型:
查看答案和解析>>【题目】温室下,用0.1molL﹣1NaOH溶液分别滴定体积均为20ml浓度均为0.1molL﹣1HCl溶液和HX溶液,溶液的pH随加入NaOH溶液体积变化图,下列说法不正确的是( )
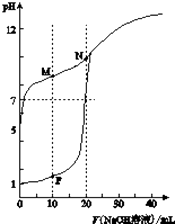
A.HX为弱酸
B.M点c(HX)﹣c(X﹣)>c(OH﹣)﹣c(H+)
C.将P点和N点的溶液为混合,呈酸性
D.向N点溶液中通入HCl至pH=7:c(Na+)>c(HX)=c(Cl﹣)>c(X﹣) -
科目: 来源: 题型:
查看答案和解析>>【题目】下列物质既属于钠盐,又属于含氧酸盐的是( )
A.Na2SO4B.NaClC.K2SO4D.NaOH
-
科目: 来源: 题型:
查看答案和解析>>【题目】设NA为阿伏加德罗常数的值,下列说法确的是
A. 常温下,22gCO2所含的共用电子对数目为NA
B. 标准状况下,22.4LNO 与11.2LO2混合后气体中分子总数小于NA
C. 将1 L 0.1mol/L FeCl3溶液滴入沸水中,制得的Fe(OH)3胶粒数目为0.1NA
D. 常温下,1L0.5mol/L NH4Cl溶液与2L0.25mol/L NH4Cl溶液中的NH4+数目相同
-
科目: 来源: 题型:
查看答案和解析>>【题目】Fenton试剂常用于氧化降解有机污染物X。在一定条件下,反应初始时c(X)=2.0×10-3mol·L-1,反应10 min进行测定,得图1和图2。下列说法不正确的是
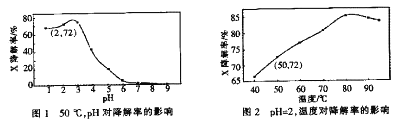
A. 50oC,PH在3~6之间,X降解率随pH增大而减小
B. pH=2,温度在40~80oC,X降解率随温度升高而增大
C. 无需再进行后续实验,就可以判断最佳反应条件是:PH=3、温度为80oC
D. pH=2、温度为50oC,10min内v(X)=1.44x10-4mol·L-1min-1
-
科目: 来源: 题型:
查看答案和解析>>【题目】硅及其化合物在材料领域中应用广泛。下列叙述不正确的是
A. 硅单质可用来制造太阳能电池
B. 硅单质是制造玻璃的主要原料
C. 石英(SiO2)可用来制作工艺品
D. 二氧化硅是制造光导纤维的材料
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列图示与对应的叙述相符的是( )
A.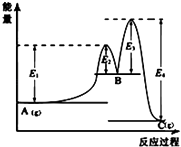
图中可以看出反应A(g)=C(g)的△H=(E1﹣E4)kJmol﹣1
B.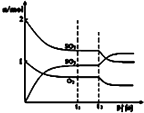
图中表示一定条件下进行的反应2SO2+O2═2SO3各成分的物质的量变化,t2时刻改变的条件可能是扩大了容器的体积
C.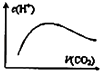
图中表示将CO2通入NaOH的稀溶液中,随着CO2的通入,溶液中水电离出的c(H+)变化关系
D.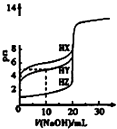
图中曲线表示用0.1000mol/L NaOH溶液分别滴定浓度相同的三种一元酸,由此可判断HX的酸性最强
相关试题

