【题目】MnSO4·H2O在工业、农业等方面有广泛的应用。软锰矿-黄铁矿硫酸浸出法是工业上制取硫酸锰的一种方法。
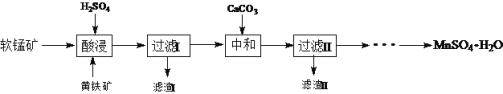
(1)酸浸时主要反应为15MnO2+2FeS2+14H2SO4= 15MnSO4 + Fe2(SO4)3 +14H2O,反应中被氧化的元素是____。酸浸时,硫酸过量的目的是:①____;②____。
(2)加入CaCO3可以将滤液中的Fe3+转化为Fe(OH)3而除去,该反应的化学方程式为____。CaCO3用量过大,对MnSO4·H2O产量的影响是,____(填“升高”“降低”或“无影响”)。
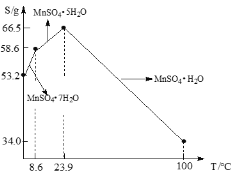
(3)硫酸锰在不同温度下结晶可分别得到MnSO4·7H2O、MnSO4·5H2O和MnSO4·H2O。硫酸锰在不同温度下的溶解度和该温度范围内析出晶体的组成如下图所示。从过滤Ⅱ所得的滤液中获得较高纯度MnSO4·H2O的操作是:控制温度在80 ℃~90 ℃之间蒸发结晶,____,使固体MnSO4·H2O与溶液分离,____、真空干燥。
参考答案:
【答案】Fe、S(或铁、硫) 提高锰元素的浸出率 抑制Mn2+水解 Fe2(SO4)3++3H2O + 3CaCO3 = 2Fe(OH)3 + 3CaSO4 + 3CO2↑ 降低 趁热过滤 用80℃~90℃的蒸馏水洗涤2~3次
【解析】
根据流程中发生的化学反应,应用混合物分离提纯的方法,逐步分析回答问题。
(1)酸浸主要反应中,锰从+4降至+2价,被还原;铁从+2升至+3价、硫从-1升至+6价,被氧化。使用过量的硫酸,可使软锰矿充分反应,提高锰元素的浸出率;多余的硫酸可抑制Mn2+、Fe3+水解,防止Mn2+生成沉淀而损失。
(2)过滤I所得滤液中Fe3+水解Fe3++3H2O![]() Fe(OH)3+3H+,中和时加入的CaCO3与H+反应CaCO3+2H+=Ca2++CO2↑+H2O,水解平衡右移Fe3+转化为Fe(OH)3沉淀,总反应的化学方程式为Fe2(SO4)3+3H2O + 3CaCO3 = 2Fe(OH)3 + 3CaSO4 + 3CO2↑。若CaCO3用量过大,部分Mn2+水解转化成Mn(OH)2沉淀混入滤渣II,使MnSO4·H2O产量降低。
Fe(OH)3+3H+,中和时加入的CaCO3与H+反应CaCO3+2H+=Ca2++CO2↑+H2O,水解平衡右移Fe3+转化为Fe(OH)3沉淀,总反应的化学方程式为Fe2(SO4)3+3H2O + 3CaCO3 = 2Fe(OH)3 + 3CaSO4 + 3CO2↑。若CaCO3用量过大,部分Mn2+水解转化成Mn(OH)2沉淀混入滤渣II,使MnSO4·H2O产量降低。
(3)据溶解度曲线图,要从过滤Ⅱ所得MnSO4溶液中获得较高纯度的MnSO4·H2O晶体,应在80 ℃~90 ℃之间进行蒸发结晶、趁热过滤,再用80℃~90℃的蒸馏水洗涤MnSO4·H2O晶体2~3次,最后真空干燥。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列物质与硫酸铁不反应的是( )
①稀硝酸 ②碳酸氢钠溶液 ③碘化钾溶液
④偏铝酸钠溶液 ⑤硫氰化钾溶液 ⑥酸性高锰酸钾溶液
A. ①⑥ B. ④⑥ C. ③④ D. ①④⑥
-
科目: 来源: 题型:
查看答案和解析>>【题目】右下表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素的核电荷数为X元素的2倍。下列说法正确的是( )
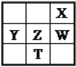
A. X、W、Z元素的原子半径及它们的气态氢化物的热稳定性均依次递增
B. Y、Z、W元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增
C. YX2晶体熔化、液态WX3气化均需克服分子间作用力
D. 根据元素周期律,可以推测T元素的单质具有半导体特性,T2X3具有氧化性和还原性
-
科目: 来源: 题型:
查看答案和解析>>【题目】烟气(主要污染物SO2、NOx)经O3预处理后用碱液吸收,可减少烟气中SO2、NOx的含量。常温下,O3是一种有特殊臭味、稳定性较差的淡蓝色气体。O3氧化烟气中NOx时主要反应的热化学方程式为:
2NO(g) +O2(g)=2NO2(g) H1= a kJ·mol-1
NO(g) +O3(g)=NO2(g) +O2(g) H2= b kJ·mol-1
4NO2(g) +O2(g) =2N2O5(g) H3= c kJ·mol-1
(1)反应6NO2 (g) +O3(g)=3N2O5(g) H=____kJ·mol-1。
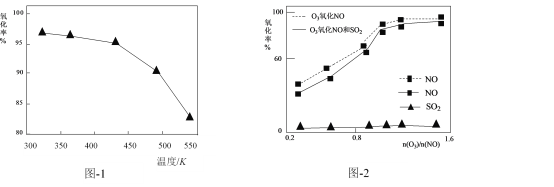
(2)O3氧化NO的氧化率随温度变化情况如图-1。随着温度升高NO的氧化率下降的原因可能是____。NO也可被O3氧化为 NO2、NO3,用NaOH溶液吸收若只生成一种盐,该盐的化学式为____。
(3)一定条件下,向NOx/O3混合物中加入一定浓度的SO2气体,进行同时脱硫脱硝实验。实验结果如图-2。同时脱硫脱硝时NO的氧化率略低的原因是____;由图可知SO2对 NO的氧化率影响很小,下列选项中能解释该结果的是____(填序号)。
a.O3氧化SO2反应的活化能较大
b.O3与NO反应速率比O3与SO2反应速率快
c.等物质的量的O3与NO反应放出的热量比与SO2反应的多
(4)尿素[CO(NH2)2]在高温条件下与NO反应转化成三种无毒气体,该反应的化学方程式为____。也可将该反应设计成碱性燃料电池除去烟气中的氮氧化物,该燃料电池负极的电极反应式是____。 -
科目: 来源: 题型:
查看答案和解析>>【题目】磷酸工业的副产品氟硅酸(H2SiF6)溶液中含少量碘,其回收方案如下。
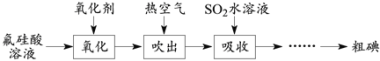
已知:①氟硅酸溶液中碘的可能存在形式为I2、I-、I3-;② I2 + I-
 I3-。
I3-。(1)K2Cr2O7、H2O2、NaClO和NaNO2都能使I-氧化为I2。NaNO2在氧化I-时会产生NO,该反应的离子方程式为____。从减少对环境污染的角度,上述氧化剂中可选用的有H2O2、____。
(2)生成的I2可用热空气吹出的原因是____。
(3)在吸收时采用气-液逆流接触,则从吸收装置底部通入的是____(填“吸收液”或“含碘空气”)。吸收后的溶液需反复多次循环吸收含碘空气,其作用是:①提高SO2的利用率;②____。
(4)请补充完整证明氟硅酸溶液中存在I
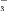 的实验步骤:取样品,____,取上层液体,重复上述操作2-3次,____。(可选用的试剂:5% 淀粉溶液、0.1 mol·L-1 NaNO2溶液,0.1 mol·L-1 Na2SO3溶液、6 mol·L-1 H2SO4溶液、CCl4)。
的实验步骤:取样品,____,取上层液体,重复上述操作2-3次,____。(可选用的试剂:5% 淀粉溶液、0.1 mol·L-1 NaNO2溶液,0.1 mol·L-1 Na2SO3溶液、6 mol·L-1 H2SO4溶液、CCl4)。 -
科目: 来源: 题型:
查看答案和解析>>【题目】某学生为了探究锌与盐酸反应过程中的速率变化。在100 mL稀盐酸中加入足量的锌粉,标准状况下测得数据累计值如下:
时间(min)
1
2
3
4
5
氢气体积(mL)
50.0
120.0
232.0
290.0
312.4
(1)解释2 min~3 min反应速率最大的原因______;反应速率最小的时间段是_____,原因为____。
(2)在4min~5 min时间段内,用盐酸的浓度变化表示的反应速率为____。
(3)为了减缓反应速率但不减少产生氢气的量,在盐酸中分别加入下列溶液:
A. Na2CO3溶液 B.Na2SO4溶液 C.NaNO3溶液 D.少量CuSO4溶液
你认为不可行的是______。
-
科目: 来源: 题型:
查看答案和解析>>【题目】世博园地区改造规划的实施将提升上海的环境质量。位于规划区的一座大型钢铁厂搬迁后,附近居民将不再受到该厂产生的棕红色烟雾的困扰。你估计这一空气污染物可能含有( )
A. FeO粉尘 B. P2O5粉尘 C. Fe2O3粉尘 D. SiO2粉尘
相关试题

