【题目】某学生为了探究锌与盐酸反应过程中的速率变化。在100 mL稀盐酸中加入足量的锌粉,标准状况下测得数据累计值如下:
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL) | 50.0 | 120.0 | 232.0 | 290.0 | 312.4 |
(1)解释2 min~3 min反应速率最大的原因______;反应速率最小的时间段是_____,原因为____。
(2)在4min~5 min时间段内,用盐酸的浓度变化表示的反应速率为____。
(3)为了减缓反应速率但不减少产生氢气的量,在盐酸中分别加入下列溶液:
A. Na2CO3溶液 B.Na2SO4溶液 C.NaNO3溶液 D.少量CuSO4溶液
你认为不可行的是______。
参考答案:
【答案】该反应是放热反应,2 min~3 min时溶液温度最高,反应速率最快 4 min~5 min 此时反应物的浓度最小,反应速率最慢 0.02 mol·L-1·min-1 A、C、D
【解析】
(1)在0~1、1~2、2~3、3~4、4~5min时间段中,产生气体的体积分别为50mL、70mL、112mL、68mL、22.4mL,生成气体体积越大的时间段,反应速率越快,结合温度、浓度对反应速率的影响分析;
(2)计算出氢气的体积,根据2HCl~H2,计算消耗盐酸的物质的量,计算浓度的变化,根据v=![]() 计算反应速率;
计算反应速率;
(3)为了减缓反应速率但不减少产生氢气的量,可降低H+浓度,但不能影响H+的物质的量。
(1)在0~1、1~2、2~3、3~4、4~5min时间段中,产生气体的体积分别为50mL、70mL、112mL、68mL、22.4mL,由此可知反应速率最快的时间段为2~3 min,因反应为放热反应,温度升高,反应速率增大,反应速率最小的时间段是4~5min时间段,此时温度虽然较高,但H+浓度小;
(2)在4min~5min时间段内,n(H2)=![]() =0.001mol,根据2HCl~H2,计算消耗盐酸的物质的量为0.002mol,则υ(HCl)=
=0.001mol,根据2HCl~H2,计算消耗盐酸的物质的量为0.002mol,则υ(HCl)= =0.02mol/(Lmin);
=0.02mol/(Lmin);
(3)A.加入Na2CO3,H+浓度减小,反应速率减小,减少产生氢气的量,故A不可行;
B.加入Na2SO4溶液,H+浓度减小,反应速率减小且不减少产生氢气的量,故B可行;
C.加入NaNO3溶液,生成NO气体,影响生成氢气的量,故C不可行;
D.加入CuSO4溶液,Zn置换出Cu反应速度增大,故D不可行;故答案为A、C、D。
-
科目: 来源: 题型:
查看答案和解析>>【题目】烟气(主要污染物SO2、NOx)经O3预处理后用碱液吸收,可减少烟气中SO2、NOx的含量。常温下,O3是一种有特殊臭味、稳定性较差的淡蓝色气体。O3氧化烟气中NOx时主要反应的热化学方程式为:
2NO(g) +O2(g)=2NO2(g) H1= a kJ·mol-1
NO(g) +O3(g)=NO2(g) +O2(g) H2= b kJ·mol-1
4NO2(g) +O2(g) =2N2O5(g) H3= c kJ·mol-1
(1)反应6NO2 (g) +O3(g)=3N2O5(g) H=____kJ·mol-1。
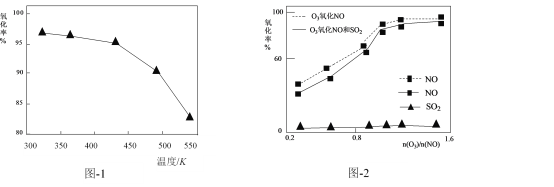
(2)O3氧化NO的氧化率随温度变化情况如图-1。随着温度升高NO的氧化率下降的原因可能是____。NO也可被O3氧化为 NO2、NO3,用NaOH溶液吸收若只生成一种盐,该盐的化学式为____。
(3)一定条件下,向NOx/O3混合物中加入一定浓度的SO2气体,进行同时脱硫脱硝实验。实验结果如图-2。同时脱硫脱硝时NO的氧化率略低的原因是____;由图可知SO2对 NO的氧化率影响很小,下列选项中能解释该结果的是____(填序号)。
a.O3氧化SO2反应的活化能较大
b.O3与NO反应速率比O3与SO2反应速率快
c.等物质的量的O3与NO反应放出的热量比与SO2反应的多
(4)尿素[CO(NH2)2]在高温条件下与NO反应转化成三种无毒气体,该反应的化学方程式为____。也可将该反应设计成碱性燃料电池除去烟气中的氮氧化物,该燃料电池负极的电极反应式是____。 -
科目: 来源: 题型:
查看答案和解析>>【题目】MnSO4·H2O在工业、农业等方面有广泛的应用。软锰矿-黄铁矿硫酸浸出法是工业上制取硫酸锰的一种方法。
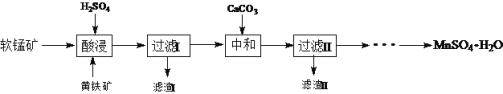
(1)酸浸时主要反应为15MnO2+2FeS2+14H2SO4= 15MnSO4 + Fe2(SO4)3 +14H2O,反应中被氧化的元素是____。酸浸时,硫酸过量的目的是:①____;②____。
(2)加入CaCO3可以将滤液中的Fe3+转化为Fe(OH)3而除去,该反应的化学方程式为____。CaCO3用量过大,对MnSO4·H2O产量的影响是,____(填“升高”“降低”或“无影响”)。
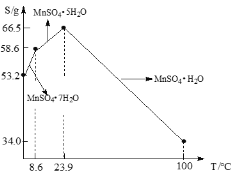
(3)硫酸锰在不同温度下结晶可分别得到MnSO4·7H2O、MnSO4·5H2O和MnSO4·H2O。硫酸锰在不同温度下的溶解度和该温度范围内析出晶体的组成如下图所示。从过滤Ⅱ所得的滤液中获得较高纯度MnSO4·H2O的操作是:控制温度在80 ℃~90 ℃之间蒸发结晶,____,使固体MnSO4·H2O与溶液分离,____、真空干燥。
-
科目: 来源: 题型:
查看答案和解析>>【题目】磷酸工业的副产品氟硅酸(H2SiF6)溶液中含少量碘,其回收方案如下。
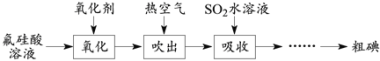
已知:①氟硅酸溶液中碘的可能存在形式为I2、I-、I3-;② I2 + I-
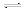 I3-。
I3-。(1)K2Cr2O7、H2O2、NaClO和NaNO2都能使I-氧化为I2。NaNO2在氧化I-时会产生NO,该反应的离子方程式为____。从减少对环境污染的角度,上述氧化剂中可选用的有H2O2、____。
(2)生成的I2可用热空气吹出的原因是____。
(3)在吸收时采用气-液逆流接触,则从吸收装置底部通入的是____(填“吸收液”或“含碘空气”)。吸收后的溶液需反复多次循环吸收含碘空气,其作用是:①提高SO2的利用率;②____。
(4)请补充完整证明氟硅酸溶液中存在I
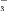 的实验步骤:取样品,____,取上层液体,重复上述操作2-3次,____。(可选用的试剂:5% 淀粉溶液、0.1 mol·L-1 NaNO2溶液,0.1 mol·L-1 Na2SO3溶液、6 mol·L-1 H2SO4溶液、CCl4)。
的实验步骤:取样品,____,取上层液体,重复上述操作2-3次,____。(可选用的试剂:5% 淀粉溶液、0.1 mol·L-1 NaNO2溶液,0.1 mol·L-1 Na2SO3溶液、6 mol·L-1 H2SO4溶液、CCl4)。 -
科目: 来源: 题型:
查看答案和解析>>【题目】世博园地区改造规划的实施将提升上海的环境质量。位于规划区的一座大型钢铁厂搬迁后,附近居民将不再受到该厂产生的棕红色烟雾的困扰。你估计这一空气污染物可能含有( )
A. FeO粉尘 B. P2O5粉尘 C. Fe2O3粉尘 D. SiO2粉尘
-
科目: 来源: 题型:
查看答案和解析>>【题目】多钒酸盐在催化、医学等领域有着重要的应用。某多钒酸铵晶体的化学式为(NH4)xH6-xV10O28·10H2O。为测定其组成, 进行下列实验:
①称取样品0.9291 g,加入过量20% NaOH溶液,加热煮沸一段时间,生成的NH3用50.00 mL 0.1000 mol·L-1 盐酸吸收。加入指示剂,用0.1000 mol·L-1 NaOH标准溶液滴定剩余的HCl,终点时消耗NaOH标准溶液20.00 mL。
②另称取样品0. 9291 g,加过量1.5 mol·L-1 H2SO4,微热溶解。加入3 g NaHSO3,搅拌,使五价钒V10O286-完全转化为四价钒VO2+。加热煮沸一段时间,然后用0. 06000 mol·L-1 KMnO4标准溶液滴定(还原产物为Mn2+),终点时消耗KMnO4标准溶液25.00 mL。
(1)在实验②中,煮沸的目的是____。
(2)KMnO4滴定时,将VO2+氧化为五价的VO2+,该反应的离子方程式为____。
(3)根据实验结果,确定该多钒酸铵晶体的化学式。____
-
科目: 来源: 题型:
查看答案和解析>>【题目】短周期元素A、B、C在周期表中所处的位置如图所示。A、B、C三种元素原子的质子数和为32。D元素原子的最外层电子数是其次外层电子数的2倍。则下列说法正确的是

A. 元素D的某种同位素质量数为14,则其中子数为6
B. 四种元素形成的气态氢化物中,C元素的氢化物的稳定性最强
C. B、C两种元素可形成BC6型化合物,该化合物属于离子化合物
D. A、B两种元素的气态氢化物均能与它们对应的最高价氧化物对应的水化物发生反应,且都属于氧化还原反应
相关试题

