【题目】下列物质与硫酸铁不反应的是( )
①稀硝酸 ②碳酸氢钠溶液 ③碘化钾溶液
④偏铝酸钠溶液 ⑤硫氰化钾溶液 ⑥酸性高锰酸钾溶液
A. ①⑥ B. ④⑥ C. ③④ D. ①④⑥
参考答案:
【答案】A
【解析】
①稀硝酸与硫酸铁不能反应,故选;②碳酸氢钠溶液与硫酸铁反应生成氢氧化铁沉淀和二氧化碳气体,不选;③碘化钾溶液被铁离子氧化生成碘单质,不选;④偏铝酸钠溶液与硫酸铁反应生成氢氧化铁沉淀和氢氧化铝沉淀,不选;⑤硫氰化钾溶液与铁离子发生显色反应,不选;⑥酸性高锰酸钾溶液与硫酸铁溶液不能反应,故选;不能反应的有①⑥,故选A。
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向水槽中滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验中不考虑两球的浮力变化)

A. 杠杆为导体或绝缘体时,均为A端高B端低
B. 杠杆为导体或绝缘体时,均为A端低B端高
C. 当杠杆为导体时,A端低B端高;杠杆为绝缘体时,A端高B端低
D. 当杠杆为导体时,A端高B端低;杠杆为绝缘体时,A端低B端高
-
科目: 来源: 题型:
查看答案和解析>>【题目】铅蓄电池反应为:Pb + PbO2 + 2H2SO4
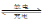 2PbSO4 + 2H2O 。下列说法中正确的是
2PbSO4 + 2H2O 。下列说法中正确的是A. PbO2得电子,被氧化
B. 铅蓄电池工作过程中每通过2mol电子,负极质量减少207g
C. 电流是由PbO2经外电路流向Pb
D. 电池放电时,溶液酸性增强
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列关于硅的说法不正确的是( )
A.硅是非金属元素,但它的单质是灰黑色有金属光泽的固体
B.硅的导电性能介于金属和绝缘体之间,是良好的半导体材料
C.硅的化学性质不活泼,常温下不与任何物质起反应
D.当加热到一定温度时,硅能与氧气、氢气等非金属反应
-
科目: 来源: 题型:
查看答案和解析>>【题目】右下表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素的核电荷数为X元素的2倍。下列说法正确的是( )
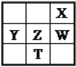
A. X、W、Z元素的原子半径及它们的气态氢化物的热稳定性均依次递增
B. Y、Z、W元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增
C. YX2晶体熔化、液态WX3气化均需克服分子间作用力
D. 根据元素周期律,可以推测T元素的单质具有半导体特性,T2X3具有氧化性和还原性
-
科目: 来源: 题型:
查看答案和解析>>【题目】烟气(主要污染物SO2、NOx)经O3预处理后用碱液吸收,可减少烟气中SO2、NOx的含量。常温下,O3是一种有特殊臭味、稳定性较差的淡蓝色气体。O3氧化烟气中NOx时主要反应的热化学方程式为:
2NO(g) +O2(g)=2NO2(g) H1= a kJ·mol-1
NO(g) +O3(g)=NO2(g) +O2(g) H2= b kJ·mol-1
4NO2(g) +O2(g) =2N2O5(g) H3= c kJ·mol-1
(1)反应6NO2 (g) +O3(g)=3N2O5(g) H=____kJ·mol-1。
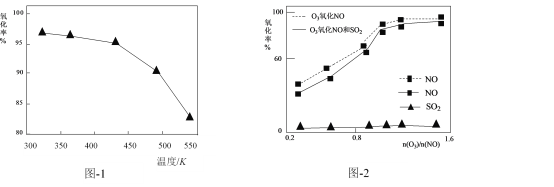
(2)O3氧化NO的氧化率随温度变化情况如图-1。随着温度升高NO的氧化率下降的原因可能是____。NO也可被O3氧化为 NO2、NO3,用NaOH溶液吸收若只生成一种盐,该盐的化学式为____。
(3)一定条件下,向NOx/O3混合物中加入一定浓度的SO2气体,进行同时脱硫脱硝实验。实验结果如图-2。同时脱硫脱硝时NO的氧化率略低的原因是____;由图可知SO2对 NO的氧化率影响很小,下列选项中能解释该结果的是____(填序号)。
a.O3氧化SO2反应的活化能较大
b.O3与NO反应速率比O3与SO2反应速率快
c.等物质的量的O3与NO反应放出的热量比与SO2反应的多
(4)尿素[CO(NH2)2]在高温条件下与NO反应转化成三种无毒气体,该反应的化学方程式为____。也可将该反应设计成碱性燃料电池除去烟气中的氮氧化物,该燃料电池负极的电极反应式是____。 -
科目: 来源: 题型:
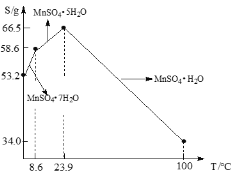
查看答案和解析>>【题目】MnSO4·H2O在工业、农业等方面有广泛的应用。软锰矿-黄铁矿硫酸浸出法是工业上制取硫酸锰的一种方法。
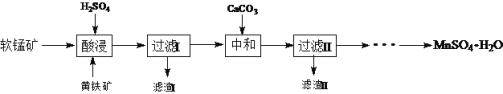
(1)酸浸时主要反应为15MnO2+2FeS2+14H2SO4= 15MnSO4 + Fe2(SO4)3 +14H2O,反应中被氧化的元素是____。酸浸时,硫酸过量的目的是:①____;②____。
(2)加入CaCO3可以将滤液中的Fe3+转化为Fe(OH)3而除去,该反应的化学方程式为____。CaCO3用量过大,对MnSO4·H2O产量的影响是,____(填“升高”“降低”或“无影响”)。
(3)硫酸锰在不同温度下结晶可分别得到MnSO4·7H2O、MnSO4·5H2O和MnSO4·H2O。硫酸锰在不同温度下的溶解度和该温度范围内析出晶体的组成如下图所示。从过滤Ⅱ所得的滤液中获得较高纯度MnSO4·H2O的操作是:控制温度在80 ℃~90 ℃之间蒸发结晶,____,使固体MnSO4·H2O与溶液分离,____、真空干燥。
相关试题

