【题目】“低碳”既是时尚,也是环保要求。“低碳”在工业生产中意义重大,充分利用原材料,不排放或减少排放“三废”,不同工厂今后联合生产等都是很好的“低碳”生产方式。下面是几个工厂利用废气、废渣(液)联合生产化肥硫酸铵的工艺:
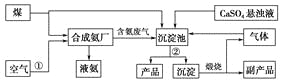
请回答下列问题:
(1)工艺操作①、②分别为____________、____________。
(2)工业合成氨的化学方程式为:__________。
(3)写出生成“产品”的离子方程式:________。
(4)在实验室中检验合成氨厂排出的废气中是否含有氨气的方法是______________。
(5)副产品的化学式为________________。该联合生产工艺中可以循环使用的物质是__________________。
参考答案:
【答案】蒸馏 过滤 N2+3H2![]() 2NH3 CaSO4+CO2+2NH3+H2O===CaCO3↓+2NH4++SO42- 用湿润的红色石蕊试纸放在导气管口,若试纸变蓝,则证明有NH3(或其他可行的方法) CaO CO2
2NH3 CaSO4+CO2+2NH3+H2O===CaCO3↓+2NH4++SO42- 用湿润的红色石蕊试纸放在导气管口,若试纸变蓝,则证明有NH3(或其他可行的方法) CaO CO2
【解析】
煤和水蒸气反应生成氢气和一氧化碳,利用空气中氮气和氢气在高温高压催化剂作用下反应生成氨气,煤燃烧生成的二氧化碳和生成的氨气和硫酸钙一起进入沉淀池中发生反应,生成碳酸钙沉淀和产品硫酸铵,碳酸钙煅烧得到副产品氧化钙,生成的二氧化碳进入沉淀池循环使用。
(1)合成氨原料之一氮气来源于空气,分离方法是将空气液化后蒸发分离出O2获得N2,所以操作①为液化;将沉淀池中的混合物经过滤可得到产品和沉淀,则操作②为过滤。因此,本题正确答案是:液化;过滤;
(2)工业上利用氮气和氢气在高温高压催化剂的条件下合成氨气,此反应的化学方程式为: N2+3H2![]() 2NH3 ,因此,本题正确答案是:N2+3H2
2NH3 ,因此,本题正确答案是:N2+3H2![]() 2NH3 。
2NH3 。
(3)产品是(NH4)2SO4,反应物是CaSO4悬浊液、CO2、NH3等,产物除(NH4)2SO4外还有CaCO3, CaSO4悬浊液在离子方程中要写分子式,反应化学方程式为: CaSO4+CO2+2NH3+H2O=CaCO3↓+(NH4)2SO4,改写成离子方程式为: CaSO4+CO2+2NH3+H2O=CaCO3↓+2NH4++SO42-;
因此,本题正确答案是: CaSO4+CO2+2NH3+H2O=CaCO3↓+2NH4++SO42- ;
(4) 检验NH3的方法是:用湿润的红色石蕊试纸放在管口处,若试纸变蓝,证明废气中有NH3存在;因此,本题正确答案是:用湿润的红色石蕊试纸放在管口处,若试纸变蓝,证明废气中有NH3;
(5) 因为CaCO3煅烧可生成CO2和CaO,其中CO2可循环使用,所以CaO为副产品,因此,本题正确答案是:CaO;CO2。
-
科目: 来源: 题型:
查看答案和解析>>【题目】亚氯酸钠(NaClO2)是重要漂白剂,探究小组开展如下实验,回答下列问题:
实验Ⅰ:制取NaClO2晶体按如下图装置进行制取。
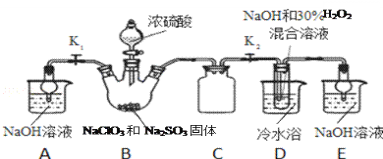
已知:NaClO2饱和溶液在低于38℃时析出NaClO23H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
(1)已知装置B中的产物有ClO2气体,则装置B中反应的化学方程式为___________;装置D中反应生成NaClO2的化学方程式为________________________;
(2)装置B中反应后的溶液中阴离子除了ClO2﹣、ClO3﹣、Cl﹣、ClO﹣、OH﹣外还肯定含有的一种阴离子是________________;检验该离子的方法是________________________;
(3)请补充从装置D反应后的溶液中获得NaClO2晶体的操作步骤。
①减压,55℃蒸发结晶;②__________;③用38℃~60℃热水洗涤;④低于60℃干燥;得到成品。
(4)如果撤去D中的冷水浴,可能导致产品中混有的杂质是________________________;
实验Ⅱ:样品杂质分析与纯度测定
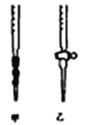
(5)测定样品中NaClO2的纯度.测定时进行如下实验:
准确称一定质量的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:ClO2﹣+4I﹣+4H+=2H2O+2I2+Cl﹣,将所得混合液稀释成100mL待测溶液。取25.00mL待测溶液,加入淀粉溶液做指示剂,用c molL﹣1 Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL
①用Na2S2O3标准溶液滴定时,应将Na2S2O3标准溶液注入________(填“甲”或“乙”)中。
②观察Na2S2O3标准溶液滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致待测溶液浓度测定值___________(选填“偏大”“偏小”或“无影响”)。
③(已知:I2+2S2O32﹣=2I﹣+S4O62﹣)。请计算所称取的样品中NaClO2的物质的量为________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某同学想通过实验探究硫和碳得电子能力的强弱,通过比较它们最高价氧化物对应水化物的酸性强弱来验证,设计了如图实验。
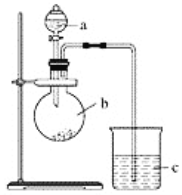
(1)仪器a的名称是________,应盛放下列药品中的________(填字母)。
A.稀硫酸 B.亚硫酸C.氢硫酸 D.盐酸
(2)仪器b的名称是________,应盛放下列药品中的________(填字母)。
A.碳酸钙 B.硫酸钠 C.氯化钠 D.碳酸钠
(3)仪器c中应盛放的试剂是________,如果看到的现象是____________________,证明b中反应产生了________,即可证明________比________酸性强,得电子能力________比________强,b中发生反应的离子方程式为______________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】在原子结构中,决定元素化学性质的主要因素是( )
A.质子数和中子数
B.核外电子数和电子层数
C.核电荷数
D.最外层电子数
-
科目: 来源: 题型:
查看答案和解析>>【题目】在实验室中,用镊子从煤油中取出一小块金属钠,然后用滤纸将煤油吸干,再用小刀切开观察。在这一实验过程中不能得出的钠的物理性质是
A. 钠在常温下是固体 B. 钠具有银白色的金属光泽
C. 钠的熔点很低 D. 金属钠很软
-
科目: 来源: 题型:
查看答案和解析>>【题目】当光束通过下列分散系时,能观察到丁达尔效应的是
A. 蔗糖溶液 B. 盐酸
C. 氯化钠溶液 D. Fe(OH)3胶体
-
科目: 来源: 题型:
查看答案和解析>>【题目】回答下列问题:
(1)已知室温下CO的燃烧热为283 kJ/mo1,则CO的燃烧热的热化学方程式为___________________________________。
(2)工业上利用CO和H2合成清洁能源CH3OH,其反应为:CO(g)+2H2(g)
 CH3OH(g) ΔH=-116kJ/mo1
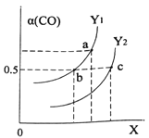
CH3OH(g) ΔH=-116kJ/mo1如图表示CO的平衡转化率(α)随温度和压强变化的示意图。X表示的是_____________,Y1_____Y2(填“<”、“=”、“>”)。
(3)合成甲醇的反应原理为:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),在1L的密闭容器中,充入1mol CO2和3mol H2,在500℃下发生反应,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g),在1L的密闭容器中,充入1mol CO2和3mol H2,在500℃下发生反应,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
①反应进行到4min时,v(正)____v(逆)(填“>”“<”或“=”)。0~4min,CO2的平均反应速率v(CO2)=____________mol·L1·min1。
②该温度下平衡常数为_____________。
③下列能说明该反应已达到平衡状态的是______________。
A.v正(CH3OH)=3v逆(H2)
B.CO2、H2、CH3OH和H2O浓度之比为1∶3∶1∶1
C.恒温恒压下,气体的体积不再变化
D.恒温恒容下,气体的密度不再变化
(4)为提高燃料的能量利用率,常将其设计为燃料电池。某电池以甲烷为燃料,空气为氧化剂,KOH溶液为电解质溶液,以具有催化作用和导电性能的稀土金属为电极。写出该燃料电池的负极反应式:_____________________________。
相关试题

