【题目】亚氯酸钠(NaClO2)是重要漂白剂,探究小组开展如下实验,回答下列问题:
实验Ⅰ:制取NaClO2晶体按如下图装置进行制取。
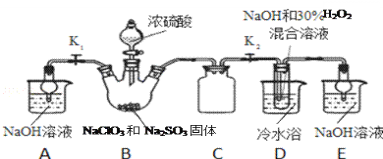
已知:NaClO2饱和溶液在低于38℃时析出NaClO23H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
(1)已知装置B中的产物有ClO2气体,则装置B中反应的化学方程式为___________;装置D中反应生成NaClO2的化学方程式为________________________;
(2)装置B中反应后的溶液中阴离子除了ClO2﹣、ClO3﹣、Cl﹣、ClO﹣、OH﹣外还肯定含有的一种阴离子是________________;检验该离子的方法是________________________;
(3)请补充从装置D反应后的溶液中获得NaClO2晶体的操作步骤。
①减压,55℃蒸发结晶;②__________;③用38℃~60℃热水洗涤;④低于60℃干燥;得到成品。
(4)如果撤去D中的冷水浴,可能导致产品中混有的杂质是________________________;
实验Ⅱ:样品杂质分析与纯度测定
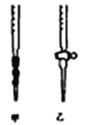
(5)测定样品中NaClO2的纯度.测定时进行如下实验:
准确称一定质量的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:ClO2﹣+4I﹣+4H+=2H2O+2I2+Cl﹣,将所得混合液稀释成100mL待测溶液。取25.00mL待测溶液,加入淀粉溶液做指示剂,用c molL﹣1 Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL
①用Na2S2O3标准溶液滴定时,应将Na2S2O3标准溶液注入________(填“甲”或“乙”)中。
②观察Na2S2O3标准溶液滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致待测溶液浓度测定值___________(选填“偏大”“偏小”或“无影响”)。
③(已知:I2+2S2O32﹣=2I﹣+S4O62﹣)。请计算所称取的样品中NaClO2的物质的量为________。
参考答案:
【答案】2NaClO3 +Na2SO3 + H2SO4= 2 ClO2↑+2Na2SO4+ H2O 2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2 SO42﹣ 取少量反应后的溶液于试管中,先加足量的盐酸,再加BaCl2溶液,若产生白色沉淀,则说明含有SO42﹣ 趁热过滤 NaClO3和NaCl 甲 偏小 cV10﹣3mol
【解析】
装置B中制备得到ClO2,所以B中反应为NaClO3和Na2SO3在浓H2SO4的作用生成 ClO2和Na2SO4,装置C为安全瓶,装置D反应后的溶液获得NaClO2晶体,装置D中生成NaClO2,Cl元素的化合价降低,双氧水应表现还原性,有氧气生成,装置E为吸收多余的气体,防止污染空气,装置A是吸收B中剩余气体。
(1)装置B中的产物有ClO2气体,则氯酸钠被还原,所以亚硫酸钠被氧化为硫酸钠,方程式为2NaClO3 +Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O;装置D中二氧化氯、氢氧化钠、过氧化氢反应生成NaClO2的化学方程式为2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2;答案为:2NaClO3 +Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O;2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2;
(2)B中生成二氧化氯,则氯酸钠被还原,所以亚硫酸钠被氧化为硫酸钠,且B中还加了浓硫酸,所以D反应后的溶液中阴离子除了ClO2-、ClO3-、Cl-、ClO-、OH-外还肯定含有的一种阴离子是SO42-;检验该离子的方法是取少量反应后的溶液,先加足量的盐酸,再加BaCl2溶液,若产生白色沉淀,则说明含有SO42﹣;答案为:SO42﹣;取少量反应后的溶液于试管中,先加足量的盐酸,再加BaCl2溶液,若产生白色沉淀,则说明含有SO42﹣;
(3)根据题中信息可知,NaClO2饱和溶液在低于38℃时析出NaClO23H2O,,高于38℃时析出NaClO2,高于60℃时NaClO2分解,故应趁热过滤,答案为:趁热过滤;
(4)使用冷水浴,说明D中的反应是放热反应。如果撤去D中的冷水浴,温度可能会高于60℃,则NaClO2分解成NaClO3和NaCl,可能导致产品中混有的杂质是NaClO3和NaCl;答案为:NaClO3和NaCl;
(5)①Na2S2O3溶液,因水解显碱性,则用碱式滴定管,使用甲装置;②若滴定前仰视,读数偏大;滴定后俯视,读数偏小,两次读数使标准液的实际体积大于读数体积,导致待测液浓度偏小;③I2+2S2O32﹣=2I﹣+S4O62﹣,n(S2O32﹣)=cmol/L![]() V mL=2n(I2)=4n(ClO2﹣),则25mL溶液中含有n(NaClO2)=
V mL=2n(I2)=4n(ClO2﹣),则25mL溶液中含有n(NaClO2)=![]() c
c![]() V
V![]() 10-3mol,100mL溶液含有n(NaClO2)=c
10-3mol,100mL溶液含有n(NaClO2)=c![]() V
V![]() 10-3mol;答案为:甲;偏小;c
10-3mol;答案为:甲;偏小;c![]() V
V![]() 10-3mol;
10-3mol;
-
科目: 来源: 题型:
查看答案和解析>>【题目】以甲醛和苯酚为主要原料,经如图所示系列转化可合成酚醛树脂和重要有机合成 中间体 D(部分反应条件和产物略去):

(1)CH3OH 的名称为_____。
(2)C 中所含官能团的名称是_____。
(3)反应②的化学方程式是_____。
(4)下列关于 A 的性质,能反映支链对苯环结构产生影响的是_____(填字母)。
a.能与氢氧化钠溶液反应 b.能使酸性高锰酸钾溶液褪色 c.稀溶液中加浓溴水产生沉淀
(5)E(C8H10O2)与 B 的水解产物互为同分异构体,1 mol E 可与 2 mol NaOH 反应,其核磁共振氢谱显示有 3 种峰且峰面积之比为 3∶1∶1,符合条件的 E 共有_____种。
(6) 完成下面以 CH3OH 和 CH3ONa 为 原 料 ( 其 他 无 机 试 剂 任 选 ) 制 备 化 合 物CH3COCH2COOCH3 的合成路线。 CH3OH――△→… ___________________________________________
-
科目: 来源: 题型:
查看答案和解析>>【题目】对于可逆反应A(g)+3B(s)
 2C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是( )
2C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是( )A. v(A)=0.5 mol·L-1·min-1
B. v(B)=1.2 mol·L-1·s-1
C. v(D)=0.4 mol·L-1·min-1
D. v(C)=0.1 mol·L-1·s-1
-
科目: 来源: 题型:
查看答案和解析>>【题目】已知:①A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2
 2CH3COOH。现以A为主要原料合成化合物E,其合成路线如图1所示。回答下列问题:
2CH3COOH。现以A为主要原料合成化合物E,其合成路线如图1所示。回答下列问题:
图1
(1)写出下列物质的官能团名称:
B:____________________;D:____________________。
(2)反应④的化学方程式为________________________________________________,反应类型:________。
(3)某学习小组设计物质B催化氧化的实验装置如下,根据图2装置回答问题。

甲 乙 丙 丁
图2
①装置甲锥形瓶中盛放的固体药品可能为________(填字母)。
A Na2O2 B KCl C Na2CO3 D MnO2
②实验过程中,丙装置硬质玻璃管中发生反应的化学方程式为_________________________。
③物质B的催化氧化产物与葡萄糖具有相同的特征反应,将所得的氧化产物滴加到新制氢氧化铜悬浊液中加热,现象为______________________________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某同学想通过实验探究硫和碳得电子能力的强弱,通过比较它们最高价氧化物对应水化物的酸性强弱来验证,设计了如图实验。
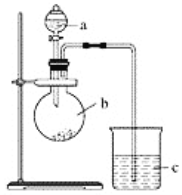
(1)仪器a的名称是________,应盛放下列药品中的________(填字母)。
A.稀硫酸 B.亚硫酸C.氢硫酸 D.盐酸
(2)仪器b的名称是________,应盛放下列药品中的________(填字母)。
A.碳酸钙 B.硫酸钠 C.氯化钠 D.碳酸钠
(3)仪器c中应盛放的试剂是________,如果看到的现象是____________________,证明b中反应产生了________,即可证明________比________酸性强,得电子能力________比________强,b中发生反应的离子方程式为______________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】在原子结构中,决定元素化学性质的主要因素是( )
A.质子数和中子数
B.核外电子数和电子层数
C.核电荷数
D.最外层电子数
-
科目: 来源: 题型:
查看答案和解析>>【题目】“低碳”既是时尚,也是环保要求。“低碳”在工业生产中意义重大,充分利用原材料,不排放或减少排放“三废”,不同工厂今后联合生产等都是很好的“低碳”生产方式。下面是几个工厂利用废气、废渣(液)联合生产化肥硫酸铵的工艺:
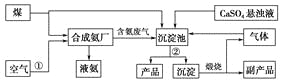
请回答下列问题:
(1)工艺操作①、②分别为____________、____________。
(2)工业合成氨的化学方程式为:__________。
(3)写出生成“产品”的离子方程式:________。
(4)在实验室中检验合成氨厂排出的废气中是否含有氨气的方法是______________。
(5)副产品的化学式为________________。该联合生产工艺中可以循环使用的物质是__________________。
相关试题

