【题目】回答下列问题:
(1)已知室温下CO的燃烧热为283 kJ/mo1,则CO的燃烧热的热化学方程式为___________________________________。
(2)工业上利用CO和H2合成清洁能源CH3OH,其反应为:CO(g)+2H2(g)![]() CH3OH(g) ΔH=-116kJ/mo1
CH3OH(g) ΔH=-116kJ/mo1
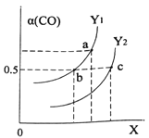
如图表示CO的平衡转化率(α)随温度和压强变化的示意图。X表示的是_____________,Y1_____Y2(填“<”、“=”、“>”)。
(3)合成甲醇的反应原理为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),在1L的密闭容器中,充入1mol CO2和3mol H2,在500℃下发生反应,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g),在1L的密闭容器中,充入1mol CO2和3mol H2,在500℃下发生反应,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。

①反应进行到4min时,v(正)____v(逆)(填“>”“<”或“=”)。0~4min,CO2的平均反应速率v(CO2)=____________mol·L1·min1。
②该温度下平衡常数为_____________。
③下列能说明该反应已达到平衡状态的是______________。
A.v正(CH3OH)=3v逆(H2)
B.CO2、H2、CH3OH和H2O浓度之比为1∶3∶1∶1
C.恒温恒压下,气体的体积不再变化
D.恒温恒容下,气体的密度不再变化
(4)为提高燃料的能量利用率,常将其设计为燃料电池。某电池以甲烷为燃料,空气为氧化剂,KOH溶液为电解质溶液,以具有催化作用和导电性能的稀土金属为电极。写出该燃料电池的负极反应式:_____________________________。
参考答案:
【答案】CO(g)+1/2O2(g)![]() CO2(g) △H=-283kJ/mo1 压强 < > 0.125 5.33(或5.3或16/3) C CH4 - 8e- + 10 OH- = CO32-+7 H2O
CO2(g) △H=-283kJ/mo1 压强 < > 0.125 5.33(或5.3或16/3) C CH4 - 8e- + 10 OH- = CO32-+7 H2O
【解析】
燃烧热为1mol纯净的可燃物完全燃烧生成稳定的化合物释放的热量;可逆反应到达平衡时,同种物质的正逆速率相等,各组分的浓度、含量保持不变,由此衍生的其它一些量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不变化说明到达平衡。
(1)根据燃烧热的概念,燃烧热的热化学方程式为:CO(g)+1/2O2(g)![]() CO2(g) △H=-283kJ/mo1;
CO2(g) △H=-283kJ/mo1;
(2) △H<0,该反应为放热反应,根据勒夏特列原理,升高温度,平衡逆向移动,CO的转化率降低,图像中曲线Y升高,根据方程可知,增大压强,体积减小,平和正向移动,则X 表示压强;当压强不变时,升高温度,平衡逆向移动,CO的转化率降低,Y1<Y2;
(3) ①通过图像可知,反应在15min时平衡,4min反应正向进行,则v(正)>v(逆);v(CO2)=![]() /
/![]() =0.5/4=0.125mol/(L·min);
=0.5/4=0.125mol/(L·min);
②该温度下平衡常数,![]() =5.33;
=5.33;
③A.反应速率之比等于化学方程式计量数之比,因此3v正(CH3OH)=v正(H2),所以v正(CH3OH)=3v逆(H2)不能说明CH3OH正逆反应速率相同,A错误;
B.平衡时反应混合物中各组分的含量保持不变,但容器内CO2、H2、CH3OH和H2O的浓度之比不一定为1: 3 :1: 1,所以不能作为平衡的标志,B错误;
C.该反应是气体分子数变化的反应,恒温恒压下,气体的体积不再变化,可以作为平衡的标志,C正确;
D. 反应前后气体的质量不变,容器的体积不变,所以密度始终保持不变,因此混合气体的密度保持不变不能作为平衡的标志,D错误;
答案为C
(4)甲烷燃料电池以甲烷为燃料,以空气为氧化剂,以KOH溶液为电解质,负极得电子,电解质溶液参与反应,电池反应为:CH4 - 8e- + 10 OH- = CO32-+7 H2O;
-
科目: 来源: 题型:
查看答案和解析>>【题目】“低碳”既是时尚,也是环保要求。“低碳”在工业生产中意义重大,充分利用原材料,不排放或减少排放“三废”,不同工厂今后联合生产等都是很好的“低碳”生产方式。下面是几个工厂利用废气、废渣(液)联合生产化肥硫酸铵的工艺:
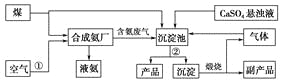
请回答下列问题:
(1)工艺操作①、②分别为____________、____________。
(2)工业合成氨的化学方程式为:__________。
(3)写出生成“产品”的离子方程式:________。
(4)在实验室中检验合成氨厂排出的废气中是否含有氨气的方法是______________。
(5)副产品的化学式为________________。该联合生产工艺中可以循环使用的物质是__________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】在实验室中,用镊子从煤油中取出一小块金属钠,然后用滤纸将煤油吸干,再用小刀切开观察。在这一实验过程中不能得出的钠的物理性质是
A. 钠在常温下是固体 B. 钠具有银白色的金属光泽
C. 钠的熔点很低 D. 金属钠很软
-
科目: 来源: 题型:
查看答案和解析>>【题目】当光束通过下列分散系时,能观察到丁达尔效应的是
A. 蔗糖溶液 B. 盐酸
C. 氯化钠溶液 D. Fe(OH)3胶体
-
科目: 来源: 题型:
查看答案和解析>>【题目】已知下列热化学方程式,有关反应焓变的判断正确的是( )
C(s)+O2(g)=CO2(g) ΔH1 CO2(g)+C(s)=2CO(g) ΔH2 2CO(g)+O2(g)=2CO2(g) ΔH3
4Fe(s)+3O2(g)=2Fe2O3(s) ΔH4 3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s) ΔH5
A. ΔH1>0,ΔH3<0 B. ΔH2>0,ΔH4>0
C. ΔH1=ΔH2+ΔH3 D. ΔH3=ΔH4+ΔH5
-
科目: 来源: 题型:
查看答案和解析>>【题目】通过以下反应可获得新型能源二甲醚(CH3OCH3)。下列说法不正确的是
①C(s) + H2O(g)==CO(g)+H2(g) ΔH1=a kJmol-1
②CO(g) + H2O(g)==CO2(g)+H2(g) ΔH2=b kJmol-1
③CO2(g)+3H2(g)==CH3OH(g)+H2O(g) ΔH3 =c kJmol-1
④2CH3OH(g) ==CH3OCH3(g)+H2O(g) ΔH4=d kJmol-1
A. 反应①②为反应③提供原料气
B. 反应③也是CO2资源化利用的方法之一
C. 反应CH3OH(g)==
 CH3OCH3(g)+
CH3OCH3(g)+  H2O(1)的ΔH =
H2O(1)的ΔH = kJmol-1
kJmol-1D. 反应 2CO(g)+4H2(g) ==CH3OCH3(g)+H2O(g)的ΔH= (2b+2c+d) kJmol-1
-
科目: 来源: 题型:
查看答案和解析>>【题目】生石灰遇水生成熟石灰,下列对此反应过程中化学键变化的判断正确的是
A.断裂离子键和共价键,形成离子键和共价键B.只断裂离子键,形成离子键和共价键
C.只断裂共价键,形成共价键D.离子键和共价键在反应前后没有变化
相关试题

