【题目】实验室欲用NaOH固体配制1.0mol/L的NaOH溶液240mL.一般可以分为以下几个步骤:
①称量 ②计算 ③溶解 ④摇匀 ⑤移液 ⑥洗涤 ⑦定容 ⑧冷却 ⑨摇动
(1)配制溶液时,其正确的操作顺序为(填序号).本实验必须用到的仪器有托盘天平、药匙、玻璃棒、烧杯、、 .
(2)某同学欲称量NaOH的质量,先用托盘天平称量烧杯的质量,托盘天平平衡后的状态如图所示.烧杯的实际质量为g,要完成本实验该同学应称量g NaOH. 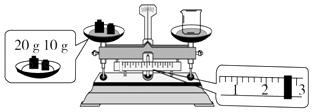
(3)使用容量瓶前必须进行的一步操作是 .
(4)配制过程中,下列操作会引起所配溶液浓度偏高的是(填序号).
A.转移溶液时,有少量溶液洒到容量瓶外面
B.定容时俯视刻度线
C.未冷却至室温就将溶液移入容量瓶中并定容
D.定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加蒸馏水至刻度线.
参考答案:
【答案】
(1)②①③⑧⑤⑨⑥⑦④;250mL容量瓶;胶头滴管
(2)27.4;10.0
(3)检查是否漏水
(4)BC
【解析】解:(1)配制一定物质的量浓度溶液的一般步骤为:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀,所以正确的操作步骤为:②①③⑧⑤⑨⑥⑦④;需要的仪器:托盘天平、药匙、玻璃棒、烧杯、容量瓶、胶头滴管,配制250mL溶液应选择250mL容量瓶,所以还需要的仪器:250mL容量瓶、胶头滴管;
所以答案是:②①③⑧⑤⑨⑥⑦④;250mL容量瓶;胶头滴管;(2)先看图中称量方式是左码右物,所称物品质量为砝码﹣游码,再据图读数,砝码20、10共30g,游码2.6g,所以烧杯质量为10+20﹣2.6=27.4g;配制1.0mol/L的NaOH溶液240mL,应选择250mL容量瓶,实际配制250mL溶液,需要溶质的质量为:1.0mol/L×0.25L×40g/mol=10.0g;
所以答案是:27.4;10.0;(3)容量瓶带有活塞,使用时需要上下颠倒摇匀,为防止漏液,使用前应检查是否漏水;
所以答案是:检查是否漏水;(4)A.转移溶液时,有少量溶液洒到容量瓶外面,导致溶质的物质的量偏小,溶液浓度偏低,故A不选;
B.定容时俯视刻度线,导致溶液体积偏小,溶液浓度偏高,故B选;
C.未冷却至室温就将溶液移入容量瓶中并定容,冷却后溶液体积偏小,溶液浓度偏高,故C选;
D.定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加蒸馏水至刻度线,导致溶液体积偏大,溶液浓度偏低,故D不选;
故选:BC.
【考点精析】本题主要考查了配制一定物质的量浓度的溶液的相关知识点,需要掌握配制物质的量浓度溶液时,先用烧杯加蒸馏水至容量瓶刻度线1cm~2cm后,再改用交投滴管加水至刻度线才能正确解答此题.
-
科目: 来源: 题型:
查看答案和解析>>【题目】在一定条件下发生下列反应,其中反应后固体质量增重的是
A. H2还原三氧化钨(W03)B. 铝与氧化铁发生铝热反应
C. 锌粒投入硫酸铜溶液中D. 过氧化钠吸收二氧化碳
-
科目: 来源: 题型:
查看答案和解析>>【题目】决定元素种类的微粒是( )。
A. 质量数 B. 中子数
C. 核外电子数 D. 质子数
-
科目: 来源: 题型:
查看答案和解析>>【题目】25 ℃、101 kPa时,强酸与强碱的稀溶液中发生中和反应的中和热为57.3 kJ·mol-1,则下列描述正确的是
A. KOH(aq)+
 H2SO4(aq)===
H2SO4(aq)=== K2SO4(aq)+H2O(1) ΔH=-57.3 kJ·mol-1
K2SO4(aq)+H2O(1) ΔH=-57.3 kJ·mol-1B. NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(1) ΔH=+57.3 kJ·mol-1
C. H2SO4和Ca(OH)2反应的中和热为ΔH=2×(-57.3) kJ·mol-1
D. 稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量
-
科目: 来源: 题型:
查看答案和解析>>【题目】利用反应:2NO(g)+2CO(g)
 2CO2(g)+N2(g) △H=-746.8kJ·mol-1,可净化汽车尾气,如果要同时提高该反应的速率和NO的转化率,采取的措施是
2CO2(g)+N2(g) △H=-746.8kJ·mol-1,可净化汽车尾气,如果要同时提高该反应的速率和NO的转化率,采取的措施是A. 降低温度 B. 增大压强
C. 升高温度同时充入N2 D. 及时将CO2和N2从反应体系中移走
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列说法正确的是( )
A. 纤维素和淀粉遇碘水均显蓝色
B. 苯、乙酸和葡萄糖均属电解质
C. 溴乙烷与NaOH乙醇溶液共热生成乙烯
D. 乙酸乙酯和食用植物油均可水解生成乙醇
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列化合物分子中,在核磁共振氢谱图中能给出三种信号的是
A. CH3CH2CH3 B. CH3COCH2CH3 C. CH3OCH3 D. CH3COOCH3
相关试题

