【题目】甲醇是一种重要的可再生能源。
(1)已知2CH4(g)+O2(g)=2CO(g)+4H2(g) ΔH =a kJ·mol-1
CO(g)+2H2(g)=CH3OH(g) ΔH =b kJ·mol-1
试写出由CH4和O2制取甲醇的热化学方程式 。
(2)还可通过下列反应制甲醇:CO(g)+2H2(g)![]() CH3OH(g)。甲图是反应时CO和CH3OH(g)的浓度随时间的变化情况。从反应开始到达平衡,用H2表示反应速率υ(H2)= 。
CH3OH(g)。甲图是反应时CO和CH3OH(g)的浓度随时间的变化情况。从反应开始到达平衡,用H2表示反应速率υ(H2)= 。
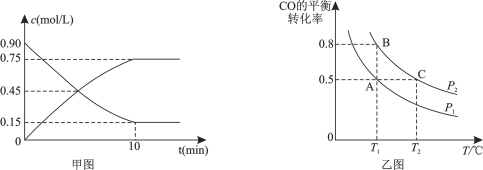
(3)在一容积可变的密闭容器中充入10 mol CO和20 mol H2,CO的平衡转化率随温度(T)、压强(P)的变化如乙图所示。
①下列说法能判断该反应达到化学平衡状态的是_______(填字母)。
A.H2的消耗速率等于CH3OH的生成速率的2倍
B.H2的体积分数不再改变
C.体系中H2的转化率和CO的转化率相等
D.体系中气体的平均摩尔质量不再改变
②比较A、B两点压强大小PA________PB(填“>、<、=”)。
③若达到化学平衡状态A时,容器的体积为20 L。如果反应开始时仍充入10 molCO和20 molH2,则在平衡状态B时容器的体积V(B)= L。
(4)以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极)。
①若KOH溶液足量,则写出电池负极反应式________________________。
②若电解质溶液中KOH的物质的量为0.8 mol,当有0.5 mol甲醇参与反应时,电解质溶液中各种离子的物质的量浓度由大到小的顺序是 。
参考答案:
【答案】(1)2CH4(g)+O2(g)=2CH3OH(g);ΔH=(a+2b) kJ·mol-1
(2)0.15mol·L-1·min-1
(3)①BD②<③4
(4)①CH3OH+8OH- -6e-=![]() +6H2O②c(K+)>c(
+6H2O②c(K+)>c(![]() )>c(
)>c(![]() )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
【解析】
试题解析:
(1)已知①2CH4(g)+O2(g)=2CO(g)+4H2(g);△H=a KJ/mol ②CO(g)+2H2(g)=CH3OH(g);△H=b KJ/mol,
①+②×2可得到2CH4(g)+O2(g)=2CH3OH(g);△H=(a+2b)kJ/mol
(2)用甲醇表示的反应速率υ(CH3OH)=![]() =0.075mol/(Lmin),氢气表示的反应速率是甲醇的2倍,即υ(H2)=0.15mol/(Lmin)。
=0.075mol/(Lmin),氢气表示的反应速率是甲醇的2倍,即υ(H2)=0.15mol/(Lmin)。
(3)①A.因为H2是反应物,甲醇是生成物,且二者计量数之比为2:1,所以无论平衡与否,反应过程中
H2的消耗速率始终等于CH3OH的生成速率的2倍,故A错误;B.H2的体积分数不再改变是化学
平衡的特征,达到了平衡状态,故B正确;C.因为体系中加入的H2和CO的物质的量之比为2: 1,
二者的计量数之比为2:1,所以反应的转化率始终相等,不能说明反应一定平衡,故C错误;D.体
系中气体的平均摩尔质量等于气体总质量和气体总物质的量的比值,总质量不变,反应时气体物质
的量减小,所以当体系中气体的平均摩尔质量不再改变时,证明反应达到了平衡,故D正确。
②正反应方向为气体体积减小的方向,T1℃时比较CO的转化率,转化率越大,则压强越大,图象中
PB转化率大于PA,可知PA<PB。
③A、B两容器温度相同,即化学平衡常数相等,根据A点时CO的转化率为0.5,容器容积为20L,
可计算出平衡常数K= =4;B点时CO的转化率为0.8,则
=4;B点时CO的转化率为0.8,则
CO(g)+2H2(g) ![]() CH3OH(g)
CH3OH(g)
起始(mol): 10 20 0
转化(mol): 8 16 8
平衡(mol): 2 4 8
设体积为VL,则有K= =4,V=4。
=4,V=4。
(4)①燃料电池总反应是燃料燃烧的化学方程式,在碱性环境下,二氧化碳转化为碳酸根离子,即
2CH3OH+3O2+4OH-=2![]() +6H2O,电池的负极是甲醇失去电子被氧化的过程:CH3OH+8OH--6e-
+6H2O,电池的负极是甲醇失去电子被氧化的过程:CH3OH+8OH--6e-
=![]() +6H2O
+6H2O
②当有0.5mol甲醇参与反应时,产生的二氧化碳是0.5mol,和0.8mol氢氧化钾反应,根据元素守恒
可以计算n (K2CO3)=0.3mol,n (KHCO3)=0.2mol,二者的水溶液均为碱性,所以c(K+)>c(CO![]() )>
)>
c (HCO![]() )>c (OH
)>c (OH![]() )>c (H+)。
)>c (H+)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】向2L密闭容器中通入amol气体A和bmol气体B,在一定条件下发生反应:
xA(g)+yB(g)
 pC(g)+qD(g) 已知:平均反应速率vC=1/2vA;反应2min时,A的浓度减少了1/3,B的物质的量减少了a/2 mol,有a mol D生成.回答下列问题:
pC(g)+qD(g) 已知:平均反应速率vC=1/2vA;反应2min时,A的浓度减少了1/3,B的物质的量减少了a/2 mol,有a mol D生成.回答下列问题:(1)反应2min内,vA=________________,vB=________________;
(2)化学方程式中,x=_____、y=_____、p=______、q=________;
(3)反应平衡时,D为2amol,则B的转化率为________________;
-
科目: 来源: 题型:
查看答案和解析>>【题目】2Zn(OH)2ZnCO3是制备活性ZnO的中间体,以锌焙砂(主要成分为ZnO,含少量Cu2、Mn2+等离子)为原料制备2Zn(OH)2ZnCO3的工艺流程如下:
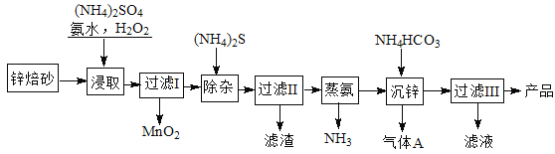
请回答下列问题:
(1)当(NH4)2SO4,NH3·H2O的混合溶液呈中性时, c(NH4+) 2c(SO42-)(填“<”、“>”或“=”)性。
(2)“浸取”时为了提高锌的浸出率,可采取的措施是 (任写一种)。
(3)“浸取”时加入的NH3·H2O过量,生成MnO2的离子方程式为 。
(4)适量S2能将Cu2+等离子转化为硫化物沉淀而除去,若选择ZnS进行除杂,是否可行?用计算说明原因: 。
[已知:Ksp(ZnS)=1.6×1024,Ksp(CuS)=1.3×1036+;K﹥105化学反应完全]
(5)“沉锌”的离子方程式为 。
(6)“过滤3”所得滤液可循环使用,其主要成分的化学式是 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】现设计如下路线合成有机物E(C6H8O4),(其中A的相对分子质量是56,B的相对分子质量是125)。

(1)烃A的分子式是,D的结构简式为______________;
(2)③的反应类型是____________反应;
(3)已知E为顺式结构,则其结构简式是____________;
(4)下列说法正确的是____________(填序号)
a.反应①属于加成反应
b.B与二氯甲烷互为同系物
c.C存在立体异构体
d.D能使溴水褪色
(5)若C转化为D经过如下4步反应完成:
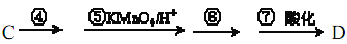 。
。则④的化学方程式是____________,⑥所需的无机试剂及反应条件是____________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】50ml0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液在如下图所示的装置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。回答下列问题:
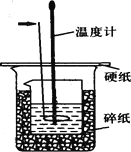
(1)箭头所指仪器的名称是 。作用是 。
(2)实验所用的NaOH溶液体积与盐酸相同,但浓度却比盐酸大的原因是 。
(3)用相同浓度和体积的醋酸代替HCl溶液进行上述实验,放出的热量会 。(填“偏大”“偏小”或“无影响”)。测得的△H会 (填“偏大”“偏小”或“无影响”)。
(4)上图所示实验装置存在着一处错误,这处错误是 。
(5)实验测得中和热△H =" -" 57.3 kJ·mol–1若忽略能量的损失,请你计算出实验前后温度的差值△t (保留一位小数,水的比热容c=4.18J/(g·℃)两种溶液的密度近似取1g/ml )
-
科目: 来源: 题型:
查看答案和解析>>【题目】A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和。
(1)A为 ,B为 ,C为 。D的最高价氧化物的水化物是 。
(2)写出A、B的化合物与E反应的化学方程式: 。
(3)A、B两元素形成化合物属 (填“离子”或“共价”)化合物。
(4)写出D的最高价氧化物的水化物和A反应的化学方程式: 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】无水三氯化铁易升华,有强烈的吸水性,是一种用途比较广泛的盐。
(1)实验室中可将FeCl3溶液 、 、过滤、洗涤干燥得FeCl3·6H2O;再 ,得到无水FeCl3。
(2)室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH为2.7时,Fe3+开始沉淀;当溶液pH为4时,c(Fe3+)= mol·L-1(已知:Ksp[Fe(OH)3]= 1.1×10-36)。
(3)利用工业FeCl3制取纯净的草酸铁晶体[Fe2(C2O4)3·5H2O]的实验流程如下图所示:
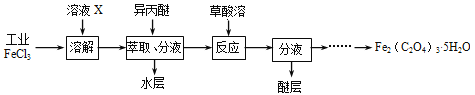
①为抑制FeCl3水解,溶液X为 。
②上述流程中FeCl3能被异丙醚萃取,其原因是 ;检验萃取、分液后所得水层中是否含有Fe3+的方法是 。
③所得Fe2(C2O4)3·5H2O需用冰水洗涤,其目的是 。
④为测定所得草酸铁晶体的纯度,实验室称取a g样品,加硫酸酸化,用KMnO4标准溶液滴定生成的H2C2O4,KMnO4标准溶液应置于右图所示仪器 (填“甲”或“乙”)中;下列情况会造成实验测得Fe2(C2O4)3·5H2O含量偏低的是 。
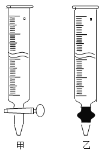
a.盛放KMnO4的滴定管水洗后未用标准液润洗
b.滴定管滴定前尖嘴部分有气泡,滴定后消失
c.滴定前仰视读数,滴定后俯视读数
相关试题

