【题目】向2L密闭容器中通入amol气体A和bmol气体B,在一定条件下发生反应:
xA(g)+yB(g)![]() pC(g)+qD(g) 已知:平均反应速率vC=1/2vA;反应2min时,A的浓度减少了1/3,B的物质的量减少了a/2 mol,有a mol D生成.回答下列问题:
pC(g)+qD(g) 已知:平均反应速率vC=1/2vA;反应2min时,A的浓度减少了1/3,B的物质的量减少了a/2 mol,有a mol D生成.回答下列问题:
(1)反应2min内,vA=________________,vB=________________;
(2)化学方程式中,x=_____、y=_____、p=______、q=________;
(3)反应平衡时,D为2amol,则B的转化率为________________;
参考答案:
【答案】(1) a/12mol/(L·min) ;a/8mol/(L·min) ;(2) x=2,y=3,p=1,q=6;(3) 100a/b%。
【解析】
试题分析:(1)根据题干信息结合平衡三段式列式,A减少量和生成C的物质的量之比等于速率之比,等于计量数之比,平均反应速率vC =vA/2,
xA(g)+yB(g)![]() pC(g)+qD(g)
pC(g)+qD(g)
起始量(mol) a b 0 0
变化量(mol) a/3 a/2 a/6 a
平衡量(mol) 2a/3 b-a/2 a/6 a
用A表示的反应速率vA=a/3mol÷2L÷2min=a/12mol/(L·min);用B表示的反应速率vB= a/2mol÷2L÷2min=a/8mol/(L·min);(2)依据(1)的列式计算x:y:p:q=a/3:a/2:a/6:a=2:3:1:6,所以x=2,y=3,p=1,q=6;(3)反应平衡时,D为 2amol,则a=2amol,则B的转化率为=(a/2mol÷bmol)×100%=100a/b%。
-
科目: 来源: 题型:
查看答案和解析>>【题目】氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
I.已知: ① 4HCl(g)+O2(g)
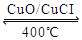 2Cl2(g)+2H2O(g)△H=-115.6kJ/mol
2Cl2(g)+2H2O(g)△H=-115.6kJ/mol②H2(g)+Cl2(g)=2HCl(g)△H=-184kJ/mol
由知断开1mol H-H键所需能量为436kJ;断开1molO=O键所需能量为496kJ;断开1molCl-Cl键所需能量为243KJ。则
(1)H2与O2反应生成气态水的热化学方程式是
(2)断开1molH-O键所需能量为 kJ。
Ⅱ.已知: CH4(g)+H2O(g)═CO(g)+3H2(g) △H=+206.2kJmol-1 ①
CH4(g)+CO2(g)═2CO(g)+2H2(g) △H=+247.4kJmol-1 ②
又知CH4的燃烧热为890.3kJ/mol。
(1)利用上述已知条件写出甲烷完全燃烧的热化学方程式: 。
(2)以甲烷为原料制取氢气是工业上常用的制氢方法,CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为________________________________。
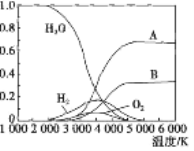
(3)高温下H2O可分解生成分子或原子。高温下水分解体系中主要气体的体积分数与温度的关系如图所示。图中B表示的微粒是_______(填名称),等质量的A、H2化学能较低的物质是_______(填化学式)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】【有机选做】有机物DBP常用作纤维素树脂和聚氯乙烯的增塑剂,特别适用于硝酸纤维素涂料。具有优良的溶解性、分散性和粘着性。由有机物A和邻二甲苯为原料可以合成DBP。
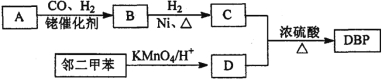
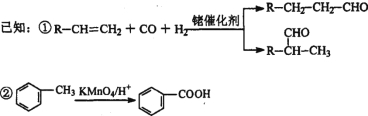
③烃A是有机合成的重要原料。A的质谱图最大m/z为42,红外光谱表明分子中含有碳碳双键;B能发生银镜反应;有机物C的核磁共振氢谱显示其分子中含有5种化学环境不同的氢原子,且个数之比为3:2:2:2:l。
回答下列问题:
(1)A的结构简式为________;A在一定条件下生成聚合物的化学方程式为_______________。
(2)D中的含氧官能团是___________。有机物D和足量有机物C反应生成DBP的化学方程式是____________________________________________。
(3)下列说法正确的是___________ (选填序号字母)。
A.A能发生聚合反应、加成反应和氧化反应
B.与C互为同分异构体,且含有相同官能团的有机物有2种
C.邻二甲苯能氧化生成D说明有机物分子中基团之间存在影响
D.1 mol DBP可与含4mol NaOH的溶液完全反应
(4)工业上常用有机物E(C8H4O3)代替D生产DBP。反应分为两步进行:
i)E+C
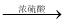 中间产物 ii)中间产物+C
中间产物 ii)中间产物+C 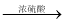 DBP+H2O
DBP+H2O①请猜测E的结构简式___________。[
②工业上生产有机物E的反应如下:2X+9O2
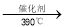 2E+4CO2+4H2O,芳香烃X的一溴代物只有两种。X的结构简式是________。
2E+4CO2+4H2O,芳香烃X的一溴代物只有两种。X的结构简式是________。 -
科目: 来源: 题型:
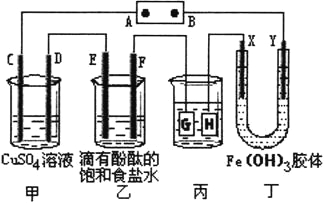
查看答案和解析>>【题目】如下图所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,丁中X极附近的颜色逐渐变浅,Y极附近的颜色逐渐变深。请回答:
(1)若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为__________。
(2)现用丙装置给铜件镀银,当乙中溶液的pH是13时(此时乙溶液体积为500mL),丙中镀件上析出银的质量为__________。
(3)Fe(OH)3胶体的制备有严格的要求,小明想向FeCl3溶液中滴加NaOH溶液来制备Fe(OH)3胶体,结果很快就生成了红褐色的沉淀。他测得溶液的pH=5,则此时溶液中c(Fe3+)=__________mol/L。(己知Ksp[Fe(OH)3]=1×10-36)。
(4)若用甲烷燃料电池(电解质溶液为2L2mol/LKOH溶液)提供电源,持续通入甲烷,在标准状况下,消耗甲烷的体积VL。当消耗CH4的体积在44.8<V≤89.6时,此时电源中B极发生的电极反应为:__________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】2Zn(OH)2ZnCO3是制备活性ZnO的中间体,以锌焙砂(主要成分为ZnO,含少量Cu2、Mn2+等离子)为原料制备2Zn(OH)2ZnCO3的工艺流程如下:
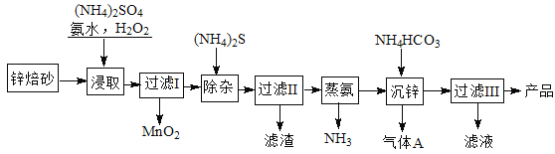
请回答下列问题:
(1)当(NH4)2SO4,NH3·H2O的混合溶液呈中性时, c(NH4+) 2c(SO42-)(填“<”、“>”或“=”)性。
(2)“浸取”时为了提高锌的浸出率,可采取的措施是 (任写一种)。
(3)“浸取”时加入的NH3·H2O过量,生成MnO2的离子方程式为 。
(4)适量S2能将Cu2+等离子转化为硫化物沉淀而除去,若选择ZnS进行除杂,是否可行?用计算说明原因: 。
[已知:Ksp(ZnS)=1.6×1024,Ksp(CuS)=1.3×1036+;K﹥105化学反应完全]
(5)“沉锌”的离子方程式为 。
(6)“过滤3”所得滤液可循环使用,其主要成分的化学式是 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】现设计如下路线合成有机物E(C6H8O4),(其中A的相对分子质量是56,B的相对分子质量是125)。

(1)烃A的分子式是,D的结构简式为______________;
(2)③的反应类型是____________反应;
(3)已知E为顺式结构,则其结构简式是____________;
(4)下列说法正确的是____________(填序号)
a.反应①属于加成反应
b.B与二氯甲烷互为同系物
c.C存在立体异构体
d.D能使溴水褪色
(5)若C转化为D经过如下4步反应完成:
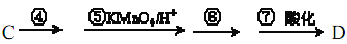 。
。则④的化学方程式是____________,⑥所需的无机试剂及反应条件是____________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】甲醇是一种重要的可再生能源。
(1)已知2CH4(g)+O2(g)=2CO(g)+4H2(g) ΔH =a kJ·mol-1
CO(g)+2H2(g)=CH3OH(g) ΔH =b kJ·mol-1
试写出由CH4和O2制取甲醇的热化学方程式 。
(2)还可通过下列反应制甲醇:CO(g)+2H2(g)
 CH3OH(g)。甲图是反应时CO和CH3OH(g)的浓度随时间的变化情况。从反应开始到达平衡,用H2表示反应速率υ(H2)= 。
CH3OH(g)。甲图是反应时CO和CH3OH(g)的浓度随时间的变化情况。从反应开始到达平衡,用H2表示反应速率υ(H2)= 。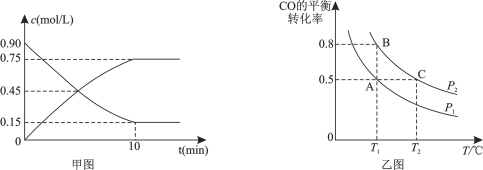
(3)在一容积可变的密闭容器中充入10 mol CO和20 mol H2,CO的平衡转化率随温度(T)、压强(P)的变化如乙图所示。
①下列说法能判断该反应达到化学平衡状态的是_______(填字母)。
A.H2的消耗速率等于CH3OH的生成速率的2倍
B.H2的体积分数不再改变
C.体系中H2的转化率和CO的转化率相等
D.体系中气体的平均摩尔质量不再改变
②比较A、B两点压强大小PA________PB(填“>、<、=”)。
③若达到化学平衡状态A时,容器的体积为20 L。如果反应开始时仍充入10 molCO和20 molH2,则在平衡状态B时容器的体积V(B)= L。
(4)以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极)。
①若KOH溶液足量,则写出电池负极反应式________________________。
②若电解质溶液中KOH的物质的量为0.8 mol,当有0.5 mol甲醇参与反应时,电解质溶液中各种离子的物质的量浓度由大到小的顺序是 。
相关试题

