【题目】A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和。
(1)A为 ,B为 ,C为 。D的最高价氧化物的水化物是 。
(2)写出A、B的化合物与E反应的化学方程式: 。
(3)A、B两元素形成化合物属 (填“离子”或“共价”)化合物。
(4)写出D的最高价氧化物的水化物和A反应的化学方程式: 。
参考答案:
【答案】(1)C(碳),O(氧),Na(钠),H2SO4(硫酸)
(2)2Na2O2+CO2=2Na2CO3+O2(3)共价(4)C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
【解析】试题分析:A、B、C、D为四种短周期元素,原子序数依次增大,B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,则固体E为Na2O2,则B为O元素、C为Na元素;A的原子序数小于B,且A原子的最外层上有4个电子,则A为C元素;D的L层电子数等于K、M两个电子层上电子数之和,则D原子M层电子数为8-2=6,核外各层电子分别为2、8、6,则D为S元素,(1)A为C元素,原子的电子式为,B为O元素, C为Na元素,D的最高价氧化物的水化物是H2SO4(硫酸)。
(2)二氧化碳与过氧化钠反应生成碳酸钠与氧气,化学反应方程式为:2Na2O2+CO2=2Na2CO3+O2。
(3)A、B两元素形成化合物是二氧化碳或一氧化碳,都属共价化合物。
(4)D的最高价氧化物的水化物是硫酸和A是碳反应的化学方程式:C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O。
CO2↑+2SO2↑+2H2O。
-
科目: 来源: 题型:
查看答案和解析>>【题目】现设计如下路线合成有机物E(C6H8O4),(其中A的相对分子质量是56,B的相对分子质量是125)。

(1)烃A的分子式是,D的结构简式为______________;
(2)③的反应类型是____________反应;
(3)已知E为顺式结构,则其结构简式是____________;
(4)下列说法正确的是____________(填序号)
a.反应①属于加成反应
b.B与二氯甲烷互为同系物
c.C存在立体异构体
d.D能使溴水褪色
(5)若C转化为D经过如下4步反应完成:
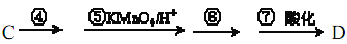 。
。则④的化学方程式是____________,⑥所需的无机试剂及反应条件是____________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】甲醇是一种重要的可再生能源。
(1)已知2CH4(g)+O2(g)=2CO(g)+4H2(g) ΔH =a kJ·mol-1
CO(g)+2H2(g)=CH3OH(g) ΔH =b kJ·mol-1
试写出由CH4和O2制取甲醇的热化学方程式 。
(2)还可通过下列反应制甲醇:CO(g)+2H2(g)
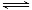 CH3OH(g)。甲图是反应时CO和CH3OH(g)的浓度随时间的变化情况。从反应开始到达平衡,用H2表示反应速率υ(H2)= 。
CH3OH(g)。甲图是反应时CO和CH3OH(g)的浓度随时间的变化情况。从反应开始到达平衡,用H2表示反应速率υ(H2)= 。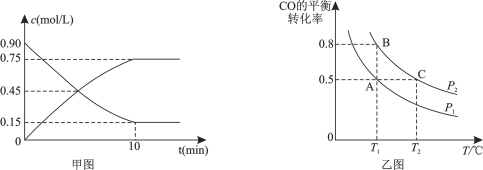
(3)在一容积可变的密闭容器中充入10 mol CO和20 mol H2,CO的平衡转化率随温度(T)、压强(P)的变化如乙图所示。
①下列说法能判断该反应达到化学平衡状态的是_______(填字母)。
A.H2的消耗速率等于CH3OH的生成速率的2倍
B.H2的体积分数不再改变
C.体系中H2的转化率和CO的转化率相等
D.体系中气体的平均摩尔质量不再改变
②比较A、B两点压强大小PA________PB(填“>、<、=”)。
③若达到化学平衡状态A时,容器的体积为20 L。如果反应开始时仍充入10 molCO和20 molH2,则在平衡状态B时容器的体积V(B)= L。
(4)以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极)。
①若KOH溶液足量,则写出电池负极反应式________________________。
②若电解质溶液中KOH的物质的量为0.8 mol,当有0.5 mol甲醇参与反应时,电解质溶液中各种离子的物质的量浓度由大到小的顺序是 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】50ml0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液在如下图所示的装置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。回答下列问题:
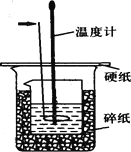
(1)箭头所指仪器的名称是 。作用是 。
(2)实验所用的NaOH溶液体积与盐酸相同,但浓度却比盐酸大的原因是 。
(3)用相同浓度和体积的醋酸代替HCl溶液进行上述实验,放出的热量会 。(填“偏大”“偏小”或“无影响”)。测得的△H会 (填“偏大”“偏小”或“无影响”)。
(4)上图所示实验装置存在着一处错误,这处错误是 。
(5)实验测得中和热△H =" -" 57.3 kJ·mol–1若忽略能量的损失,请你计算出实验前后温度的差值△t (保留一位小数,水的比热容c=4.18J/(g·℃)两种溶液的密度近似取1g/ml )
-
科目: 来源: 题型:
查看答案和解析>>【题目】无水三氯化铁易升华,有强烈的吸水性,是一种用途比较广泛的盐。
(1)实验室中可将FeCl3溶液 、 、过滤、洗涤干燥得FeCl3·6H2O;再 ,得到无水FeCl3。
(2)室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH为2.7时,Fe3+开始沉淀;当溶液pH为4时,c(Fe3+)= mol·L-1(已知:Ksp[Fe(OH)3]= 1.1×10-36)。
(3)利用工业FeCl3制取纯净的草酸铁晶体[Fe2(C2O4)3·5H2O]的实验流程如下图所示:
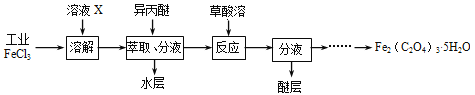
①为抑制FeCl3水解,溶液X为 。
②上述流程中FeCl3能被异丙醚萃取,其原因是 ;检验萃取、分液后所得水层中是否含有Fe3+的方法是 。
③所得Fe2(C2O4)3·5H2O需用冰水洗涤,其目的是 。
④为测定所得草酸铁晶体的纯度,实验室称取a g样品,加硫酸酸化,用KMnO4标准溶液滴定生成的H2C2O4,KMnO4标准溶液应置于右图所示仪器 (填“甲”或“乙”)中;下列情况会造成实验测得Fe2(C2O4)3·5H2O含量偏低的是 。
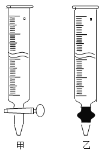
a.盛放KMnO4的滴定管水洗后未用标准液润洗
b.滴定管滴定前尖嘴部分有气泡,滴定后消失
c.滴定前仰视读数,滴定后俯视读数
-
科目: 来源: 题型:
查看答案和解析>>【题目】下表是稀硫酸与某金属反应的实验数据:

分析上述数据,回答下列问题:
(1) 实验4和5表明_________对反应速率有影响;________,反应速率越快,能表明这一规
律另一组实验是___________(填实验序号)。
(2) 在前4次实验中,能表明反应物浓度对反应速率产生影响的实验有____(填序号)。
(3) 本实验中影响反应速率的其他因素还有_________,其实验序号是_____。
(4) 实验中,反应前后溶液的温度变化值(约15℃)相近,推测其原因:
_________________________________________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】X、Y、Z三种元素的离子都和氩原子具有相同的电子层排布。X元素单质能在氢气中燃烧,产生苍白色火焰;Y元素氢化物的分子式是H2Y,其最高氧化物含有40%的Y;Z元素的离子具有紫色的焰色反应。
(1)根据以上条件,推断元素名称:X:_____,Y:_____,Z:________。
(2)X、Y、Z最高价氧化物对应的水化物的酸性由强到弱的顺序是________。
(3)用电子式表示Z2Y的形成过程:___________,其化合物中化学键的类型是________。
相关试题

