【题目】苯胺(![]() )是重要的化工原料。某兴趣小组在实验室里制取并纯化苯胺。
)是重要的化工原料。某兴趣小组在实验室里制取并纯化苯胺。
已知:①![]() 与NH3相似,与盐酸反应生成
与NH3相似,与盐酸反应生成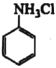 (易溶于水的盐)。
(易溶于水的盐)。
②用硝基苯制取苯胺的反应为:2![]() +3Sn+12HCl
+3Sn+12HCl![]() 2
2![]() +3SnCl4+4H2O
+3SnCl4+4H2O
③有关物质的部分物理性质见下表:
物质 | 相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 | 密度/g·cm-3 |
苯胺 | 93 | 6.3 | 184 | 微溶于水,易溶于乙醚 | 1.02 |
硝基苯 | 123 | 5.7 | 210.9 | 难溶于水,易溶于乙醚 | 1.23 |
乙醚 | 74 | 116.2 | 34.6 | 微溶于水 | 0.7134 |
Ⅰ.制备苯胺
图1所示装置中加入20mL浓盐酸(过量),置于热水浴中回流20min,使硝基苯充分还原;冷却后,向三颈烧瓶中滴入一定量50%NaOH溶液,至溶液呈碱性。
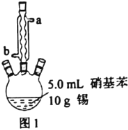
(1)滴加适量NaOH溶液的目的是___,写出主要反应的离子方程式___。
ⅰ.取出图l所示装置中的三颈烧瓶,改装为图2所示装置。加热装置A产生水蒸气。用“水蒸气蒸馏”的方法把B中苯胺逐渐吹出,在烧瓶C中收集到苯胺与水的混合物;分离混合物得到粗苯胺和水溶液甲。
ⅱ.向所得水溶液甲中加入氯化钠固体至饱和,再用乙醚萃取,得到乙醚萃取液。
iii.合并粗苯胺和乙醚萃取液,用NaOH固体干燥,蒸馏后得到苯胺1.86g。
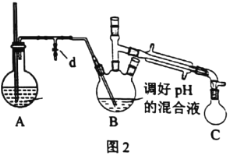
(2)装置A中玻璃管的作用是__。
(3)在苯胺吹出完毕后,应进行的操作是先__,再___。
(4)该实验中苯胺的产率为___(保留三位有效数字)。
(5)欲在不加热条件下除去苯胺中少量的硝基苯杂质,简述实验方案___。
参考答案:
【答案】与C6H5NH3+发生中和反应,生成C6H5NH2 C6H5NH3++OH-![]() C6H5NH2+H2O 安全管、平衡压强、防止气压过大等 打开止水夹d 撤掉酒精灯或停止加热 40.0% 在混合物中先加入足量盐酸,经分液除去硝基苯,再向水溶液中加氢氧化钠溶液,析出苯胺,分液后用氢氧化钠固体(或碱石灰)干燥苯胺中含有的少量水分,滤去氢氧化钠固体即可得较纯净的苯胺
C6H5NH2+H2O 安全管、平衡压强、防止气压过大等 打开止水夹d 撤掉酒精灯或停止加热 40.0% 在混合物中先加入足量盐酸,经分液除去硝基苯,再向水溶液中加氢氧化钠溶液,析出苯胺,分液后用氢氧化钠固体(或碱石灰)干燥苯胺中含有的少量水分,滤去氢氧化钠固体即可得较纯净的苯胺
【解析】
(1)![]() 与NH3相似,NaOH与
与NH3相似,NaOH与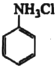 反应生成
反应生成![]() ;
;
(2)装置A中玻璃管与空气连通,能平衡烧瓶内外的压强;
(3)为防止倒吸,在苯胺吹出完毕后,打开止水夹d,再停止加热;
(4)根据硝基苯的体积计算苯胺的理论产量,实际产量÷理论产量=产率;
(5)根据 易溶于水、硝基苯难溶于水设计分离方案;
易溶于水、硝基苯难溶于水设计分离方案;
(1)![]() 与NH3相似,加入氢氧化钠,NaOH与
与NH3相似,加入氢氧化钠,NaOH与 反应生成
反应生成![]() ,反应的离子方程式是
,反应的离子方程式是 ;
;
(2)装置A中玻璃管与空气连通,能平衡烧瓶内外的压强,所以玻璃管的作用是安全管、平衡压强、防止气压过大;
(3)为防止倒吸,先打开止水夹d,再停止加热;
(4)5mL硝基苯的质量是5mL×1.23 g·cm-3=6.15g,物质的量是![]() =0.05mol,根据质量守恒定律,生成苯胺的物质的量是0.05mol,苯胺的质量是0.05mol×93g/mol=4.65g,苯胺的产率是
=0.05mol,根据质量守恒定律,生成苯胺的物质的量是0.05mol,苯胺的质量是0.05mol×93g/mol=4.65g,苯胺的产率是![]() =40.0%;
=40.0%;
(5)在混合物中先加入足量盐酸,经分液除去硝基苯,再向水溶液中加氢氧化钠溶液,析出苯胺,分液后用氢氧化钠固体(或碱石灰)干燥苯胺中含有的少量水分,滤去氢氧化钠固体即可得较纯净的苯胺。
-
科目: 来源: 题型:
查看答案和解析>>【题目】2019年诺贝尔化学奖授予三位开发锂离子电池的科学家。TiS2、LiCoO2、LiFePO4、LiMnO2、Cu与磷的化合物等都是研究电池的常用材料。请回答下列问题。
(1)Co4+中存在__种不同能量的电子。
(2)你预测第一电离能:Cu__Zn(填“>”或“<”)。请说出你的理由:__。
(3)已知下列化合物的熔点:
化合物
AlF3
GaF3
AlCl3
熔点/℃
1040
1000
194
表格中卤化物的熔点产生差异的原因是:___。
(4)直链多磷酸盐的阴离子有复杂的结构,焦磷酸根离子、三磷酸根离子结构如图:

这类磷酸根离子的化学式可用通式表示为___(用n代表P原子数)。
(5)钴蓝晶胞结构如图1所示,该立方晶胞由4个Ⅰ型和4个Ⅱ型小立方体构成如图2,则钴蓝晶体的化学式为___。在晶体中,某些原子位于其它原子围成的空隙中,如图3中●原子就位于最近的4个原子围成的正四面体空隙中。在钴蓝晶体中,Al3+位于O2-形成的___空隙中。若阿伏加德罗常数用NA表示,则钴蓝晶体的密度为___g·cm-3(列计算式即可,不必化简)。

-
科目: 来源: 题型:
查看答案和解析>>【题目】二硫化钼是重要的固体润滑剂,被誉为“高级固体润滑油之王”。利用低品相的辉钼矿(含MoS2、SiO2以及CuFeS2等杂质)制备高纯二硫化钼的一种生产工艺如图:
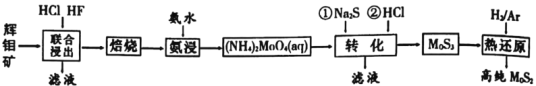
(1)(NH4)2MoO4中Mo的化合价为___。
(2)“焙烧”时MoS2转化为MoO3的化学方程式为___。
(3)“转化”中第一步加入Na2S后,(NH4)2MoO4转化为(NH4)2MoS4,写出第二步(NH4)2MoS4与盐酸生成MoS3的离子方程式为___。
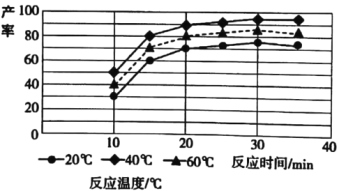
(4)由图分析可知产生MoS3沉淀的流程中选择的最优温度和时间是__,利用化学平衡原理分析低于或高于最优温度时,MoS3的产率均下降的原因___。
(5)利用低品相的原料制备高纯产品是工业生产中的普遍原则。如图所示,反应[Ni(s)+4CO(g)
 Ni(CO)4(g)] ΔH<0在充满CO的石英管中进行,先在温度为T2的一端放入未提纯的粗镍粉末,一段时间后,在温度为T1的一端得到了纯净的镍粉,请结合平衡移动原理,判断温度Tl___T2(填“>”、“<”或“=”)。
Ni(CO)4(g)] ΔH<0在充满CO的石英管中进行,先在温度为T2的一端放入未提纯的粗镍粉末,一段时间后,在温度为T1的一端得到了纯净的镍粉,请结合平衡移动原理,判断温度Tl___T2(填“>”、“<”或“=”)。
(6)已知Ksp(BaSO4)=1.1×10-10,Ksp(BaMoO4)=4.0×10-8,不纯的Na2MoO4溶液中若含少量可溶性硫酸盐杂质,可加入Ba(OH)2固体除去SO42-(忽略溶液体积变化),则当SO42-完全沉淀时,溶液中c(MoO42-)<___mol/L(保留2位有效数字)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】“清肺排毒汤”对新冠肺炎病毒感染具有良好的效果,其中一味中药黄芩的一种活性中间体的结构为:
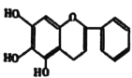 ,现在可人工合成,路线如图所示:
,现在可人工合成,路线如图所示: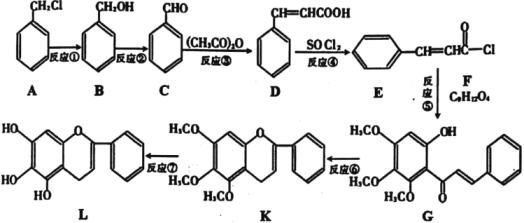
(1)A生成B的反应条件是___,B生成C的反应条件为___。
(2)合成过程中,属于取代反应的是___。
(3)F的结构简式为___。
(4)D在一定条件下能生成高分子化合物,请写出该反应的化学方程式___。同时符合下列三个条件的D的同分异构体共有___种。
a.能发生银镜反应;
b.苯环上有3个取代基;
c.与FeCl3溶液发生显色反应。
(5)依据以上合成信息,以乙烯和氯苯为原料合成
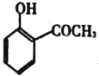 路线,无机试剂自选___。
路线,无机试剂自选___。 -
科目: 来源: 题型:
查看答案和解析>>【题目】碳及其化合物的用途广泛,碳元素不仅能形成丰富多彩的有机化合物,而且还能形成多种无机化合物,同时自身可以形成多种单质。
(1)C60分子形成的晶体中,在晶胞的顶点和面心均含有一个C60分子,则一个C60晶胞的质量为____。
(2)干冰和冰是两种常见的分子晶体,下列关于两种晶体的比较中正确的是____。
a. 晶体的密度:干冰>冰 b. 晶体的熔点:干冰>冰
c. 晶体中的空间利用率:干冰>冰 d. 晶体中分子间相互作用力类型相同
(3)金刚石和石墨是碳元素形成的两种常见单质,下列关于这两种单质的叙述中正确的有____。
a. 金刚石中碳原子的杂化类型为sp3杂化,石墨中碳原子的杂化类型为sp2杂化
b. 晶体中共价键的键长:金刚石中C-C<石墨中C-C
c. 晶体的熔点:金刚石>石墨
d. 晶体中共价键的键角:金刚石>石墨
e. 金刚石晶体中只存在共价键,石墨晶体中则存在共价键、金属键和范德华力
f. 金刚石和石墨的熔点都很高,所以金刚石和石墨都是原子晶体
(4)金刚石晶胞结构如图所示,立方BN结构与金刚石相似,在BN晶体中,B原子周围最近的N原子所构成的立体图形为____,一个晶胞中N原子数目为____。
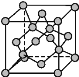
(5)碳与孔雀石共热可以得到金属铜,金属铜采用面心立方最密堆积,即在晶胞的顶点和面心均含有一个Cu原子,则Cu晶体中Cu原子的配位数为___。已知Cu晶体的密度为ρ g·cm-3,Cu的相对原子质量为M,阿伏加德罗常数为NA,则Cu的原子半径为____。
-
科目: 来源: 题型:
查看答案和解析>>【题目】Ⅰ.CO2催化加氢制甲醇是极具前景的资源化研究领域,主要反应有:
i.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH1=-49.4kJ·mol-1
CH3OH(g)+H2O(g) ΔH1=-49.4kJ·mol-1ii.CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH2=+41.2kJ·mol-1
CO(g)+H2O(g) ΔH2=+41.2kJ·mol-1iii.CO(g)+2H2(g)
 CH3OH(g) ΔH3
CH3OH(g) ΔH3(1)ΔH3=___kJ·mol-1。
(2)已知反应i的速率方程为v正=k正x(CO2)·x3(H2),v逆=k逆·x(CH3OH)·x(H2O),k正、k逆均为速率常数且只与温度有关,x为物质的量分数。其物质的量分数平衡常数Kx=___(以k正、k逆表示)。
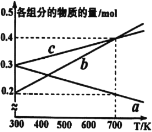
(3)5MPa时,往某密闭容器中按投料比n(H2):n(CO2)=3:1充入H2和CO2。反应达平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。
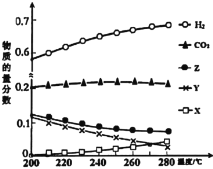
①图中Y代表___(填化学式)。
②250℃时反应ii的Kx___1(填“>”、“<”或“=”)
③下列措施中,一定无法提高甲醇产率的是___。
A.加入适量CO B.使用催化剂
C.循环利用原料气 D.升高温度
(4)在10MPa下将H2、CO按一定比例投料,平衡状态时各组分的物质的量与温度的关系如图所示。曲线b代表的物质为____(填化学式)。温度为700K时,该反应的平衡常数KP=___(MPa)-2(结果用分数表示)。
Ⅱ.在恒容容器中,使用某种催化剂对反应NO2(g)+SO2(g)
 SO3(g)+NO(g) ΔH<0
SO3(g)+NO(g) ΔH<0进行相关实验探究。改变投料比[n(SO2):n(NO2)]进行多组实验(各次实验的温度可能相同,也可能不同),测定SO2的平衡转化率[α(SO2)]实验结果如图所示。
已知:KR=16,KZ=
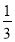 。
。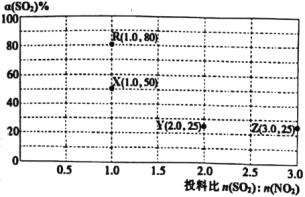
(5)如果要将图中R点的平衡状态改变为X点的平衡状态。应采取的措施是___。
(6)通过计算确定图中R、X、Y、Z四点中温度相等的点是__。
-
科目: 来源: 题型:
查看答案和解析>>【题目】设NA为阿伏加德罗常数值。如图表示N2O在Pt2O+表面与CO反应转化成无害气体的过程。下列说法正确的是
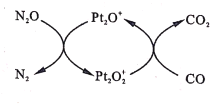
A.N2O转化成无害气体时的催化剂是Pt2O2+
B.每1mol Pt2O+转化为Pt2O2+得电子数为3NA
C.将生成的CO2通人含大量SiO32-、Na+、Cl-的溶液中,无明显现象
D.1g CO2 、N2O的混合气体中含有电子数为0.5NA
相关试题

