【题目】根据所学知识,回答问题:
Ⅰ.在第三周期元素及其单质和化合物中,氧化性最强的单质是__________,还原性最强的单质是__________;最高价氧化物对应的水化物中,最强的酸是__________,最强的碱是_________,形成的两性氢氧化物是__________;化学性质最稳定的元素是__________。
Ⅱ.(1)A元素原子的核电荷数为8,其原子核内的质子数为__________,该元素原子的二价阴离子的核外电子数为_________,中子数是8的核素表示为__________。
(2)B元素原子的一价阳离子的核外有10个电子,质量数为23,该元素原子的原子核内中子数为__________。
(3)A、B形成1:1型化合物的相对分子质量是__________。
参考答案:
【答案】Cl2 Na HCIO4 NaOH Al(OH)3 Ar 8 10 ![]() 12 78
12 78
【解析】
I.同一周期的元素,从左到右元素的金属性逐渐减弱,非金属性逐渐增强。元素的金属性越强,单质的还原性越强,最高价氧化物对应的水化物的碱性越强;元素的非金属性越强,其单质的氧化性越强,最高价含氧酸的酸性越强;处于金属与非金属交界处的Al的氢氧化物显两性;惰性气体原子达到最外层8个(He为2个)电子的稳定结构;
II.8号元素是O,原子最外层有6个电子,容易获得2个电子变为O2-,达到最外层8个电子稳定结构;根据原子核外电子数等于原子核内质子数等于原子序数分析;原子获得电子形成阴离子,原子失去电子形成阳离子,质量数等于原子核内质子数与中子数的和,B一价阳离子的核外有10个电子,则B是Na元素,二者1:1形成的化合物是Na2O2,该物质是离子化合物。
I.由于同一周期的元素,从左到右元素的金属性逐渐减弱,非金属性逐渐增强,所以在第三周期元素及其单质和化合物中,氧化性最强的单质是Cl2,还原性最强的单质是Na;元素的金属性越强,最高价氧化物对应的水化物的碱性越强;元素的非金属性越强,最高价含氧酸的酸性越强,所以最高价氧化物对应的水化物中,最强的酸是HCIO4,最强的碱是NaOH,处于金属与非金属交界处的Al的氢氧化物显两性,则形成的两性氢氧化物是Al(OH)3;处于元素周期表每一周期最后的惰性气体元素的原子达到最外层8个(He为2个)电子的稳定结构,所以第三周期元素中,化学性质最稳定的元素是Ar。
Ⅱ.(1)A元素原子的核电荷数为8,该元素是O元素,原子核内的质子数为8,核外电子排布是2、6,最外层有6个电子,容易获得2个电子,达到最外层8个电子的稳定结构,形成O2-,该元素原子的二价阴离子的核外电子数为10,中子数是8的核素表示为![]() ;
;
(2)B元素原子的一价阳离子的核外有10个电子,说明原子失去1个电子后有10个电子,因此B元素是11号Na元素,质量数为23,该元素原子的原子核内中子数为23-11=12;
(3)A、B形成1:1型化合物是Na2O2,其相对分子质量是23×2+16×2=78。
-
科目: 来源: 题型:
查看答案和解析>>【题目】(12分)下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:

(1)④、⑤、⑥的原子半径由大到小的顺序为___________________。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是____________。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:____________________。
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号)_________________。
a.MnO2 b.FeCl3c.Na2SO3d.KMnO4
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
X溶液与Y溶液反应的离子方程式为_____________________,
N→⑥的单质的化学方程式为________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列说法正确的是( )
A.氯化氢溶于水能电离出H+、Cl-,所以氯化氢是离子化合物
B.碘晶体受热转变成碘蒸气,破坏了共价键
C.CH3CH2CH2OH和CH3CH2OCH3互为同分异构体
D.加热氧化镁使之熔化克服的是共价键
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列离子能大量共存的是( )
A.H+,Ag+,NO3-,Na+
B.Ca2+,Cl-,HCO3-,NO3-
C.Fe3+,SO42-,Cl-,OH-
D.H+,Cl-,Ac-,NH4+
-
科目: 来源: 题型:
查看答案和解析>>【题目】A~J是中学化学中常见的物质,它们之间的转化关系如图所示(部分产物已略去)。已知A是一种高熔点物质,D是一种红棕固体,H的焰色呈黄色。

请回答下列问题:
(1)A物质的化学式为______________,H物质的名称为______________。
(2)G→J的实验现象是______________________________________________,化学方程式为____________________________。
(3)D与C高温下反应的化学方程式为____________________________。
(4)D物质与盐酸恰好反应的离子方程式为____________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】向体积为2
 的容器中加入1
的容器中加入1 N2和6molH2进行可逆反应:N2(g)+3H2(g)
N2和6molH2进行可逆反应:N2(g)+3H2(g) 2NH3(g),2
2NH3(g),2 后测得N2的物质的量为0.6mol,则:
后测得N2的物质的量为0.6mol,则:(1)2
 内,H2的物质的量减少了_______mol,NH3的物质量增加了______mol。
内,H2的物质的量减少了_______mol,NH3的物质量增加了______mol。(2)若用N2的浓度变化来表示该反应的反应速率为__________mol/(L·min)。
(3)若用NH3的浓度变化来表示该反应的反应速率为_________ mol/(L·min)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】短周期元素A、B、C在元素周期表中的位置如图所示,已知A、B、C三种元素的原子核外电子数之和等于B的质子数的2倍。据此回答下列问题:
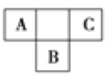
(1)A的气态氢化物的化学式为_________。
(2)B的元素符号为__________,在周期表中位于___________________。
(3)C的单质的化学式为__________,其氢化物的水溶液可用于雕刻玻璃。
相关试题

