

【题目】回答下列问题:
(1)已知室温下CO的燃烧热为283kJ/mol,则CO的燃烧热的热化学方程式为____。
(2)工业上利用CO和H2合成清洁能源CH3OH,其反应为:CO(g)+2H2(g)![]() CH3OH(g) H=-116kJ/mol,如图①表示CO的平衡转化率(
CH3OH(g) H=-116kJ/mol,如图①表示CO的平衡转化率(![]() )随温度和压强变化的示意图中横坐标X表示的是_________,Y1______Y2(填“<”、“=”、“>”);
)随温度和压强变化的示意图中横坐标X表示的是_________,Y1______Y2(填“<”、“=”、“>”);
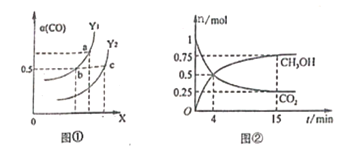
(3)合成甲醇的反应原理为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),在0.5L的密闭器中,充入1 mol CO2和3molH2,在500℃下生反应,测得CO2(g和CH3OH(g)的量随时间变化如图②所示。
CH3OH(g)+H2O(g),在0.5L的密闭器中,充入1 mol CO2和3molH2,在500℃下生反应,测得CO2(g和CH3OH(g)的量随时间变化如图②所示。
①反应进行到4min时,v(正)____v(逆)(填“<”、“=”、“>”),0~4min,H2的平均反应速率v(H2)=_____________;
②该温度下平衡常数为_____________;
③下列能说明该反应已达到平衡状态的是___________;
A. v正(CH3OH)=3v逆(H2)
B.CO2、H2、CH3OH和H2O浓度之比为1:3:1:1
C.恒温恒压下,气体的体积不再变化
D.恒温恒容下,气体的密度不再变化
(4)为提高燃料的能量利用率,常将其设计为燃料电池。某电池以甲醇为燃料,空气为氧化剂,KOH溶液为电解质溶液,以具有催化作用和导电性能的稀土金属为电极写出该燃料电池的负极反应式:_________。
【答案】CO(g)+ ![]() O2(g) = CO2(g) △H=-283kJ/mo1 压强 < > 0.75 mol·L1·min1
O2(g) = CO2(g) △H=-283kJ/mo1 压强 < > 0.75 mol·L1·min1 ![]() C CH3OH - 6e- + 8 OH- = CO32-+6H2O
C CH3OH - 6e- + 8 OH- = CO32-+6H2O
【解析】
(1)根据CO的燃烧热为283kJ/mo1,结合燃烧热的化学方程式的书写要求书写;
(2)CO(g)+2H2(g)CH3OH(g)△H=-116kJ/mo1,反应是气体体积减小的放热反应,图象中CO 的平衡转化率随X增大而增大,相同条件下Y1和Y2条件下一氧化碳转化率Y1>Y2,结合温度和压强对平衡的影响分析判断;
(3)①图象分析4min时,甲醇和二氧化碳浓度随时间增长变化,反应未达到平衡状态,根据图像先计算v(CO2),再根据方程式计算v(H2);②15min反应达到平衡状态,根据平衡时甲醇的物质的量为0.75mol,结合三段式计算平衡常数K;③根据正逆反应速率相同,各组分含量保持不变分析判断;
(4)负极发生氧化反应,甲醇被氧化生成碳酸钾,据此书写电极反应式。
(1)CO的燃烧热为283kJ/mo1,则燃烧热的热化学方程式为CO(g)+![]() O2(g)CO2(g)△H=-283kJ/mo1,故答案为:CO(g)+
O2(g)CO2(g)△H=-283kJ/mo1,故答案为:CO(g)+![]() O2(g)CO2(g)△H=-283kJ/mo1;
O2(g)CO2(g)△H=-283kJ/mo1;
(2)CO(g)+2H2(g)CH3OH(g)△H=-116kJ/mo1,该反应是气体体积减小的放热反应,图象中CO 的平衡转化率随X增大而增大,则X 表示的是压强,Y表示的是温度,相同条件下,在Y1和Y2条件下一氧化碳转化率Y1>Y2,升高温度,平衡逆向移动,则温度Y1<Y2,故答案为:压强;<;
(3)①反应进行到4min 时,随时间变化,甲醇增加,二氧化碳减小,说明反应继续正向进行,v(正)>v(逆);0~4min,二氧化碳物质的量变化1mol-0.5mol=0.5mol,CO2的平均反应速率v(CO2)= =0.25mol/(Lmin),则v(H2)=3 v(CO2)=3×0.25mol/(Lmin)=0.75mol/(Lmin),故答案为:>;0.75 mol/(Lmin);
=0.25mol/(Lmin),则v(H2)=3 v(CO2)=3×0.25mol/(Lmin)=0.75mol/(Lmin),故答案为:>;0.75 mol/(Lmin);
②15min反应达到平衡状态,甲醇平衡浓度为0.75mol/L,二氧化碳平衡浓度为0.25mol/L,
CO2(g)+3H2(g)CH3OH(g)+H2O(g)
起始量(mol) 1 3 0 0
变化量(mol) 0.75 2.25 0.75 0.75
平衡量(mol) 0.25 0.75 0.75 0.75
K= =
=![]() ,故答案为:
,故答案为:![]() ;
;
③A.速率之比等于化学方程式中的化学计量数之比,3v正(CH3
(4)燃料电池中,通入燃料的为负极,负极发生氧化反应,甲醇被氧化生成碳酸钾,电极方程式为CH3OH - 6e- + 8 OH- = CO32-+6H2O,故答案为:CH3OH - 6e- + 8 OH- = CO32-+6H2O。


 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:
【题目】有一种新型药物,具有血管扩张活性的选择性β1肾上腺素受体拮抗剂,用于合成该药物的中间体G的部分流程如下:
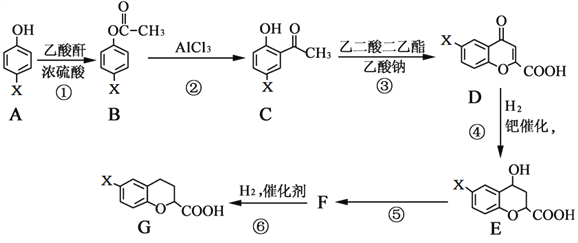
已知:乙酸酐的结构简式为:![]()
请回答下列问题:
(1)G物质中的含氧官能团的名称是________、________。
(2)反应A→B的化学方程式为_________________________________________。
(3)上述④、⑤变化过程的反应类型分别是_______________、______________。
(4)有机物F的结构简式为______________________。
(5)写出满足下列条件的C的同分异构体的结构简式:___________、___________。
Ⅰ. 苯环上只有两种取代基。
Ⅱ. 分子中只有4种不同化学环境的氢。
Ⅲ. 能与NaHCO3反应生成CO2。
(6)根据已有知识并结合相关信息,补充完成以![]() 和乙酸酐为原料制备
和乙酸酐为原料制备![]() 的合成路线流程图(无机试剂任选)。部分合成路线流程图如下:
的合成路线流程图(无机试剂任选)。部分合成路线流程图如下:

请完成合成路线_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素R、X、Y、Z的原子序数依次增大,Y、Z原子最外层电子数之和等于X原子最外层电子数的2倍,R和Y位于同主族。R、X和Z构成一种分子的结构式如图所示,下列说法错误的是( )
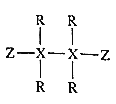
A.原子半径:Y>Z>X>R
B.YR和YZ都是离子化合物
C.Z的氧化物对应的水化物是强酸
D.常温常压下,X的氢化物可能呈液态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M(C16H14O2)是一种香料,工业上利用烃A和甲苯为主要原料,按下列路线合成:

已知:①气态烃A在标准状况下的密度是1.25g/L,能作为果实催熟剂;②醛在碱性溶液中能发生羟醛缩合反应,再脱水生成不饱和醛:RCH2CHO+ 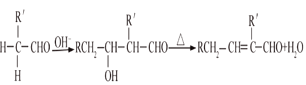 。请回答下列问题:
。请回答下列问题:
(1)K的名称是___________;G中含有的官能团名称是______________。
(2)写出D→E的化学方程式____________________________________。
(3)A→B的反应类型是_______;
(4)同时满足下列三个条件的K的同分异构体有_____种(不考虑立体异构)。①遇FeCl3溶液发生显色反应;②能发生银镜反应;③除苯环以外不再含有其他环状结构。其中核磁共振氢谱为五组峰的结构简式为____。
(5)以乙醇为起始原料,选用必要的无机试剂设计合成1-丁烯的路线。(用结构简式表示有机物,箭头上注明试剂和反应条件)____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关离子晶体的数据大小比较不正确的是( )
A. 晶格能:NaF>NaCl>NaBr
B. 硬度:MgO>CaO>BaO
C. 熔点:NaF>MgF2>AlF3
D. 阴离子的配位数:CsCl>NaCl>CaF2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷既是重要的能源也是重要的化工原料。
已知反应CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g),起始时向体积为V的恒容密闭容器中通入2molCH4和3molNO2,测得CH4、N2、H2O的物质的量浓度与时间的关系如图所示。
N2(g)+CO2(g)+2H2O(g),起始时向体积为V的恒容密闭容器中通入2molCH4和3molNO2,测得CH4、N2、H2O的物质的量浓度与时间的关系如图所示。
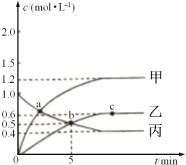
(1)容器体积V=_____L。
(2)图中表示H2O的物质的量浓度与时间关系的是曲线_____(填“甲”“乙"或"丙")。
(3)0~5min内,用N2表示的化学反应速率为_____mol·L-1·min-1。
(4)a、b、c三点中达到平衡的点是______。达到平衡时,NO2的转化率是_____。(物质平衡转化率=转化的物质的量/起始的物质的量×100%)。
(5)a点时,n(CH4):n(NO2)=_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,A、B、C三种气体在恒容密闭容器中进行反应,反应从0~2min进行过程中,在不同反应时间各物质的量的变化情况如图所示。
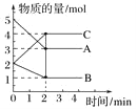
(1)该反应的反应物是____________,生成物是________。
(2)化学方程式为___________________________________________。
(3)能否计算反应开始至2min时,用C表示的反应速率?________,若不能,则其原因是_________________________________________________。
(4)关于该反应的说法正确的是________(填字母,下同)。
a.到达2min时,反应停止
b.在2min之前A的消耗速率大于A的生成速率
c.在2min时达到平衡状态是因为此时反应物总物质的量与生成物总物质的量相等
d.2min时正反应速率与逆反应速率相等
(5)下列可判断反应已达到平衡状态的是________。
a.A、B、C的反应速率相等
b.A、B的反应速率之比为2∶1
c.混合气体的压强不变
d.生成1molC的同时消耗1molA和0.5molB
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁被称为“第一金属”,铁及其化合物在生产、生活中有广泛用途。
(1)铁原子核外电子发生跃迁时会吸收或释放不同的光,可以用___摄取铁元素的原子光谱。
(2)FeC13的熔点为306℃,沸点为315℃。由此可知FeC13属于____晶体。FeSO4常作净水剂和补铁剂,SO42-的立体构型是____。
(3)铁氰化钾 K3[Fe(CN)6]是检验Fe2+的重要试剂。
①基态N原子的轨道表示式为____。
②写出一种与铁氰化钾中配体互为等电子体的极性分子的化学式_____。
③铁氰化钾中,所涉及的元素的第一电离能由大到小的顺序为____。
④铁氰化钾中,不存在___(填字母标号)。
A.离子键 B.σ键 C.π键 D.氢键 E.金属键
(4)有机金属配位化合物二茂铁[(C5H5)2Fe]是汽油中的抗震剂。分子中的大Π键可用符号![]() 表示,其中m代表参与形成大Π键的原子数,n代表参与形成大Π键的电子数(如苯分子中的大Π键可表示为
表示,其中m代表参与形成大Π键的原子数,n代表参与形成大Π键的电子数(如苯分子中的大Π键可表示为![]() ),则
),则![]() 中的大Π键应表示为____,其中碳原子的杂化方式为____。
中的大Π键应表示为____,其中碳原子的杂化方式为____。
(5)羰基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等。1molFe(CO)5分子中含__mol配位键。
(6)某种磁性氮化铁的结构如图所示,N随机排列在Fe构成的正四面体空隙中。其中铁原子周围最近的铁原子个数为___;六棱柱底边长为acm,高为c cm,阿伏加德罗常数的值为NA,则该磁性氮化铁的晶体密度为____g/cm3(列出计算式)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com