【题目】铁被称为“第一金属”,铁及其化合物在生产、生活中有广泛用途。
(1)铁原子核外电子发生跃迁时会吸收或释放不同的光,可以用___摄取铁元素的原子光谱。
(2)FeC13的熔点为306℃,沸点为315℃。由此可知FeC13属于____晶体。FeSO4常作净水剂和补铁剂,SO42-的立体构型是____。
(3)铁氰化钾 K3[Fe(CN)6]是检验Fe2+的重要试剂。
①基态N原子的轨道表示式为____。
②写出一种与铁氰化钾中配体互为等电子体的极性分子的化学式_____。
③铁氰化钾中,所涉及的元素的第一电离能由大到小的顺序为____。
④铁氰化钾中,不存在___(填字母标号)。
A.离子键 B.σ键 C.π键 D.氢键 E.金属键
(4)有机金属配位化合物二茂铁[(C5H5)2Fe]是汽油中的抗震剂。分子中的大Π键可用符号![]() 表示,其中m代表参与形成大Π键的原子数,n代表参与形成大Π键的电子数(如苯分子中的大Π键可表示为
表示,其中m代表参与形成大Π键的原子数,n代表参与形成大Π键的电子数(如苯分子中的大Π键可表示为![]() ),则
),则![]() 中的大Π键应表示为____,其中碳原子的杂化方式为____。
中的大Π键应表示为____,其中碳原子的杂化方式为____。
(5)羰基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等。1molFe(CO)5分子中含__mol配位键。
(6)某种磁性氮化铁的结构如图所示,N随机排列在Fe构成的正四面体空隙中。其中铁原子周围最近的铁原子个数为___;六棱柱底边长为acm,高为c cm,阿伏加德罗常数的值为NA,则该磁性氮化铁的晶体密度为____g/cm3(列出计算式)。

【答案】光谱仪 分子 正四面体 ![]() CO
CO ![]() DE
DE ![]()
![]() 10 12
10 12 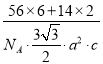
【解析】
(1)可以用光谱仪摄取铁元素的原子光谱;
(2)FeC13的熔沸点不高,由此可知FeC13属于分子晶体,根据VSEPR模型,可判断SO42-的立体构型是正四面体形;
(3)①N为7号元素,基态N原子的轨道表示式为![]() ;
;
②铁氰化钾中配体为CN-,与CN-互为等电子体的极性分子的化学式为CO;
③铁氰化钾中,所涉及的元素的第一电离能由大到小的顺序为![]() ;
;
④铁氰化钾中,钾离子和铁氰酸根离子键是离子键,C和N之间存在σ键和π键,不存在氢键和金属键,氢键存在于电负性大的非金属和与电负性大的非金属相连的氢原子之间,金属键存在于金属单质中,故选DE;
(4)则![]() 中的大Π键存在于五个C原子之间,5个C原子提供6个电子形成大Π键,应表示为
中的大Π键存在于五个C原子之间,5个C原子提供6个电子形成大Π键,应表示为![]() ,由于C原子间存在双键,故C的杂化方式应为
,由于C原子间存在双键,故C的杂化方式应为![]() 杂化;
杂化;
(5)羰基铁中,碳和铁之间、氧和碳之间,均存在配位键,故1molFe(CO)5分子中含10mol配位键;
(6)可以根据图示正六棱柱,想象两个六棱柱上下摞在一起,则可以轻松的找到,距离底面面心的Fe原子最近的铁原子有底面顶点的6个铁原子和分别处于上下两个六棱柱中心的3个铁原子,共12个,该磁性氮化铁的晶体密度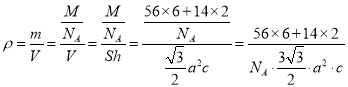 。
。

