【题目】某温度下,A、B、C三种气体在恒容密闭容器中进行反应,反应从0~2min进行过程中,在不同反应时间各物质的量的变化情况如图所示。
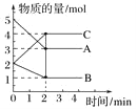
(1)该反应的反应物是____________,生成物是________。
(2)化学方程式为___________________________________________。
(3)能否计算反应开始至2min时,用C表示的反应速率?________,若不能,则其原因是_________________________________________________。
(4)关于该反应的说法正确的是________(填字母,下同)。
a.到达2min时,反应停止
b.在2min之前A的消耗速率大于A的生成速率
c.在2min时达到平衡状态是因为此时反应物总物质的量与生成物总物质的量相等
d.2min时正反应速率与逆反应速率相等
(5)下列可判断反应已达到平衡状态的是________。
a.A、B、C的反应速率相等
b.A、B的反应速率之比为2∶1
c.混合气体的压强不变
d.生成1molC的同时消耗1molA和0.5molB
【答案】A和B C 2A+B![]() 2C 不能 没有说明体积,无法计算各物质物质的量浓度的变化值 bd c
2C 不能 没有说明体积,无法计算各物质物质的量浓度的变化值 bd c
【解析】
(1)化学反应时,反应物的物质的量减少,生成物的物质的量增大;
(2)反应时,各物质减少的物质的量之比等于化学计量数之比,可确定反应的方程式;
(3)反应速率v=![]() ,反应容器的体积未知,则无法计算各物质物质的量浓度的变化值,无法计算出反应速率。
,反应容器的体积未知,则无法计算各物质物质的量浓度的变化值,无法计算出反应速率。
(4)a.到达2min时,反应达到平衡状态,各物质的物质的量不为零,则反应速率不为零,反应未停止;
b.在2min之前反应未达到平衡状态,A的物质的量减小,则A的消耗速率大于A的生成速率;
c.在2min时达到平衡状态是各反应物消耗的物质的量与生成的物质的量相等;
d.2min时达到平衡状态,同一物种的正反应速率与逆反应速率相等。
(5)a.A、B、C的反应速率相等时,不能判断同一物种的正反应速率与逆反应速率是否相等,则不能判断反应是否达到平衡状态;
b.A、B的反应速率之比反应自始至终为2∶1,不能判断反应是否达到平衡状态;
c.反应为体系中气体减小的反应,在恒容的容器中,达到平衡状态时,气体的物质的量不再改变,则混合气体的压强不变;
d.反应进行时,每生成1molC的同时,必然消耗1molA和0.5molB,与是否达到平衡状态无关。
(1)化学反应时,反应物的物质的量减少,生成物的物质的量增大;根据图像可知,A、B的物质的量减小,为反应物;C的物质的量增大,为生成物。
(2)反应时,各物质减少的物质的量之比等于化学计量数之比,A减少2mol,B减少1mol,C增大2mol,A、B、C的化学计量数之比为2:1:2,方程式为2A+B![]() 2C。
2C。
(3)化学反应速率v=![]() ,反应容器的体积未知,则无法计算各物质物质的量浓度的变化值,无法计算出反应速率。
,反应容器的体积未知,则无法计算各物质物质的量浓度的变化值,无法计算出反应速率。
(4)a.到达2min时,反应达到平衡状态,各物质的物质的量不为零,则反应速率不为零,反应未停止,a错误;
b.在2min之前反应未达到平衡状态,A的物质的量减小,则A的消耗速率大于A的生成速率,b正确;
c.在2min时达到平衡状态是各反应物消耗的物质的量与生成的物质的量相等,c错误;
d.2min时达到平衡状态,同一物种的正反应速率与逆反应速率相等,d正确;
答案为bd。
(5)a.A、B、C的反应速率相等时,不能判断同一物种的正反应速率与逆反应速率是否相等,则不能判断反应是否达到平衡状态,a错误;
b.A、B的反应速率之比反应自始至终为2∶1,不能判断反应是否达到平衡状态,b错误;
c.反应为体系中气体减小的反应,在恒容的容器中,达到平衡状态时,气体的物质的量不再改变,则混合气体的压强不变,c正确;
d.反应进行时,每生成1molC的同时,必然消耗1molA和0.5molB,与是否达到平衡状态无关,d错误;
答案为c。

