【题目】将0.2 mol KMnO4在一定温度下加热后生成a mol O2;将剩余固体与过量浓盐酸混合加热又生成b mol Cl2,此时锰元素均以Mn2+形式存在。若a+b=m,则m的值可能为( )
A. 0.30 B. 0.35
C. 0.40 D. 0.50
参考答案:
【答案】C
【解析】KMnO4固体在一定温度下加热,反应后的残留固体中与过量的浓盐酸,收集到气体为氯气,根据电子转移守恒,整个过程中,Mn元素获得电子等于O元素、Cl元素获得的电子,则有:0.2×(7-2)=4a+2b,整理得a+b=0.5-a,当高氯酸钾没有分解时,即a=0,(a+b)达极大值,故(a+b)<0.5,当高锰酸钾完全分解生成氧气时,生成氧气最多,生成氯气最少,由2KMnO4![]() K2MnO4+MnO2+O2↑,可知生成氧气最大的物质的量为0.2mol×
K2MnO4+MnO2+O2↑,可知生成氧气最大的物质的量为0.2mol×![]() =0.1mol,故a+b≥0.5-0.1=0.4,故选C。
=0.1mol,故a+b≥0.5-0.1=0.4,故选C。
-
科目: 来源: 题型:
查看答案和解析>>【题目】工业上用铋酸钠(NaBiNO3)检验溶液中的Mn2+,反应方程式为:4MnSO4+10NaBiO3+14H2SO4═4NaMnO4+5Bi2(SO4)3+3Na2SO4+口,下列说法不正确的是
A. 口内的物质为水,配平系数为14。
B. 若生成1mol NaMnO4,则转移5mole-
C. 反应方程式中的硫酸可换为盐酸
D. 溶液中有Mn2+的现象是溶液变为紫红色
-
科目: 来源: 题型:
查看答案和解析>>【题目】利用废旧镀锌铁皮制备磁性Fe3O4胶体粒子及副产物ZnO,制备流程图如下:
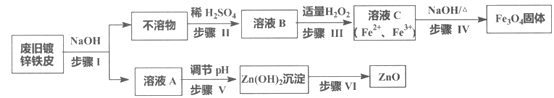
已知反应:①Zn+2NaOH=Na2ZnO2+H2↑ ②Zn(OH)2+2NaOH=Na2ZnO2+2H2O
回答下列问题:
(1)步骤I中的分离操作名称是_______,溶液A中的溶质有_______(填化学式)。
(2)步骤III中反应的离子方程式是___________________________________。
(3)步骤IV中反应的离子方程式是____________________________。
(4)步骤V可选用的试剂是_______(填序号)。
a. NaOH溶液 b. 氨水 c. 盐酸
(5)步骤VI的实验操作是______________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】能正确表示下列反应的离子方程式是( )
A. 向次氯酸钠溶液中通入足量SO2气体:ClO-+SO2+H2O==HClO+HSO3-
B. 0.1mol/LNH4Al(SO4)2溶液与0.2mol/LBa(OH)2溶液等体积混合: Al3++2SO42-+2Ba2++4OH- =2BaSO4+AlO2-+ 2H2O
C. 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO
 + 6H+ + 5H2O2 = 2Mn2+ + 5O2↑ + 8H2O
+ 6H+ + 5H2O2 = 2Mn2+ + 5O2↑ + 8H2OD. Fe2O3溶于过量氢碘酸溶液中:Fe2O3+6H+ +2I-=2Fe2+ +I2 +3H2O
-
科目: 来源: 题型:
查看答案和解析>>【题目】某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验。
实验一 制取氯酸钾和氯水
利用下图所示的实验装置进行实验。

(1)制取实验结束后,取出B中试管冷却结晶、过滤、洗涤。该实验操作过程需要的主要玻璃仪器有烧杯、玻璃棒、________________________。
(2)若对调B和C装置的位置,________(填“能”或 “不能”)提高B中氯酸钾的产率。
实验二 氯酸钾与碘化钾反应的探究
(3)在不同条件下KClO3可将KI氧化为I2或KIO3。该小组设计了系列实验研究反应条件对反应产物的影响,其中系列a实验的记录表如下(实验在室温下进行):
试管编号
1
2
3
4
0.20 mol·L-1 KI/mL
1.0
1.0
1.0
1.0
KClO3(s)/g
0.10
0.10
0.10
0.10
6.0 mol·L-1 H2SO4/mL
0
3.0
6.0
9.0
蒸馏水/mL
9.0
6.0
3.0
0
实验现象
①系列a实验的实验目的是__________________________________________。
②若2号试管实验现象为“黄色溶液”,取少量该溶液加入淀粉溶液显蓝色;假设氧化产物唯一,还原产物为KCl
,则此反应的离子方程式为__________________________________。 实验三 测定饱和氯水中氯元素的总量
(4)该小组设计的实验方案:使用下图装置,加热15.0 mL 饱和氯水试样,测定产生气体的体积。此方案不可行的主要原因是______________________________________。
(不考虑实验装置及操作失误导致不可行的原因)

(5)根据下列资料,为该小组设计一个可行的实验方案(不必描述操作过程的细节): ______________。
资料:i.次氯酸会破坏酸碱指示剂;
ii.次氯酸或氯气可被SO2、H2O2、FeCl2等物质还原成Cl-。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某反应中反应物与生成物有:FeCl2、FeCl3、CuCl2、Cu

(1)将上述反应设计成的原电池如图甲所示,请回答下列问题:
①图中X溶液是___________
②Cu电极上发生的电极反应式为__________
③原电池工作时,盐桥中的_____离子(填“K+”或“Cl-”)不断进入X溶液中。
(2)将上述反应设计成的电解池如图乙所示,乙烧杯中金属阳离子的物质的量与电子转移的物质的量的变化关系如图丙,请回答下列问题:
①M是______极;
②图丙中的②线是_________离子的变化。
③当电子转移为2mol时,向乙烧杯中加入_____L5mol/LNaOH溶液才能使所有的金属阳离子沉淀完全。
(3)铁的重要化合物高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂,具有很多优点。
①高铁酸钠生产方法之一是电解法,其原理为Fe+2NaOH+2H2O
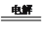 Na2FeO4+3H2↑,则电解时阳极的电极反应式是__________
Na2FeO4+3H2↑,则电解时阳极的电极反应式是__________②高铁酸钠生产方法之二是在强碱性介质中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和水,该反应的离子方程式为___________
-
科目: 来源: 题型:
查看答案和解析>>【题目】实验室模拟工业漂白液(有效成分为NaClO)脱除废水中氨氮(NH3)的流程如下:
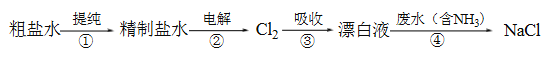
下列分析正确的是
A. ①中采用蒸馏的方法精制粗盐水
B. ②中阳极的主要电极反应:4OH- - 4e- = 2H2O + O2↑
C. ③中制备漂白液的反应:Cl2 + OH- = Cl- + HClO
D. ②、③、④中均发生了氧化还原反应
相关试题

