【题目】工业上,向500﹣600℃的铁屑中通入氯气生产无水氯化铁;向炽热铁屑中通入氯化氢生产无水氯化亚铁.现用如图所示的装置模拟上述过程进行实验. 
回答下列问题:
(1)制取无水氯化铁的实验中,A中反应的化学方程式为 , 当生成1molCl2时,转移的电子数为 , 玻璃丝的作用是 , 装置B中加入的试剂是 . 装置D中加入的试剂是 .
(2)制取无水氯化亚铁的实验中,尾气的成分是 . 若仍用D的装置进行尾气处理,存在的问题是、 .
(3)若操作不当,制得的FeCl2 会含有少量FeCl3杂质,下列说法中正确的是
A.检验FeCl3常用的试剂是KSCN溶液
B.可向固体混合物中加入适量Fe粉除去杂质
C.可向固体混合物中通入适量Cl2除去杂质
D.欲制得纯净的FeCl2 , 在实验操作中应先点燃A处的酒精灯,在点燃C处的酒精灯.
(4)现有一包FeCl2和FeCl3混合物,某化学兴趣小组为测定各成分的含量进行如下两个实验:
实验1:①称取一定质量的样品,将样品溶解;②向溶解后的溶液中加入足量的AgNO3溶液,产生沉淀;③将沉淀过滤、洗涤、干燥得到白色固体28.7g.
实验2:①称取与实验1中相同质量的样品,溶解;②加入足量的NaOH溶液,③将沉淀过滤、洗涤后,加热灼烧到质量不再减少,得到固体6.4g.
则样品中FeCl3的物质的量为 .
参考答案:
【答案】
(1)MnO2+4H++2Cl﹣ ![]() ?Mn2++Cl2↑+2H2O;2NA;防堵塞;浓硫酸;NaOH溶液
?Mn2++Cl2↑+2H2O;2NA;防堵塞;浓硫酸;NaOH溶液
(2)HCl和H2;生倒吸;可燃性气体H2不能被吸收
(3)AD
(4)0.04mol
【解析】解:(1)实验室利用二氧化锰与浓盐酸加热反应制取氯气,反应的离子方程式为:MnO2+4H++2Cl﹣ ![]() Mn2++Cl2↑+2H2O,当生成1molCl2时,转移的电子数为2NA , 玻璃丝的作用是防止堵塞导气管,向500﹣600℃的铁屑中通入氯气生产无水氯化铁,生成的氯气需要干燥,装置B中应是浓硫酸,反应后剩余的氯气不能排放到空气中,需要用氢氧化钠溶液进行尾气吸收,所以答案是:MnO2+4H++2Cl﹣
Mn2++Cl2↑+2H2O,当生成1molCl2时,转移的电子数为2NA , 玻璃丝的作用是防止堵塞导气管,向500﹣600℃的铁屑中通入氯气生产无水氯化铁,生成的氯气需要干燥,装置B中应是浓硫酸,反应后剩余的氯气不能排放到空气中,需要用氢氧化钠溶液进行尾气吸收,所以答案是:MnO2+4H++2Cl﹣ ![]() Mn2++Cl2↑+2H2O;2NA;防堵塞;浓硫酸;NaOH溶液;
Mn2++Cl2↑+2H2O;2NA;防堵塞;浓硫酸;NaOH溶液;
(2.)制取无水氯化亚铁,需要HCl气体,尾气的成分是剩余HCl和生成的氢气,HCl极易溶解于水,氢气不能溶于水,若仍用D的装置进行尾气处理易发生倒吸,氢气不能被吸收,所以答案是:HCl和H2;生倒吸;可燃性气体H2不能被吸收;
(3.)A.检验氯化铁常用硫氰化钾溶液,铁离子遇到KSCN溶液生成血红色溶液,故A正确;
B.实验目的是制备无水氯化铁,加入铁粉需要在溶液中和氯化铁反应生成氯化亚铁,故B错误;
C.氯气和氯化铁不反应,和氯化亚铁反应生成氯化铁,不能得到氯化亚铁,故C错误;
D.若要制取纯净的FeCl2 , 需先排净装置中的空气,防止在加热时Fe与O2反应,故先点燃A处的酒精灯,再点燃C处的酒精灯,故D正确;
所以答案是:A、D;
(4.)FeCl3和FeCl2的物质的量分别为amol,bmol;
则有3amol+2bmol= ![]() =0.2mol(氯守恒)
=0.2mol(氯守恒)
amol+bmol= ![]() ×2=0.08mol(铁守恒)
×2=0.08mol(铁守恒)
解得:a=0.04,b=0.04
FeCl3的物质的量为0.04mol,
所以答案是:0.04mol.
【考点精析】本题主要考查了氯气的实验室制法的相关知识点,需要掌握实验室制法:MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O才能正确解答此题.
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图所示,某同学设计了一个甲醚(CH3OCH3)燃料电池并探究氯碱工业原理和原理和粗铜的精炼原理,乙装置中X为阳离子交换膜。根据要求回答下列相关问题:

(1)通入氧气的电极为_____(填“正极”或“负极”),写出负极的电极反应式_____.
(2)铁电极为_____(填“阳极”或“阴极”),石墨电极的电极反应式为_____.
(3)反应一段时间后,乙装置中生成NaOH主要在_____(填“铁极”或“石墨极”)区.
(4)如果粗铜中含有锌、银等杂质,丙装置中阳极上电极反应式为_____,反应一段时间,硫酸铜溶液浓度将_____(填“增大”“减小”或“不变”).
(5)若在标准状况下,有2.24L氧气参加反应,则乙装置中铁电极上生成的气体在标准状况下的体积为_____;丙装置中阴极析出铜的质量为_____.
-
科目: 来源: 题型:
查看答案和解析>>【题目】(1)钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的电极反应式为__________、_______。
(2)用甲烷制取氢气的两步反应的能量变化如下图所示:

甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式是________________。
(3)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) △H=-159.5KJ/mol
②NH2CO2NH4(s)= CO(NH2)2(s) +H2O(g) △H=+116.5KJ/mol
③H2O(l)=H2O(g) △H=+44KJ/mol
写出CO2与NH3合成尿素和液态水的热化学方程式__________________。
(4)氨气在纯氧中燃烧,生成一种单质和水。科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极在碱性条件下发生反应的电极反应式为_________________。
-
科目: 来源: 题型:
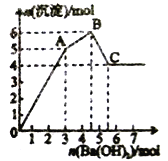
查看答案和解析>>【题目】向FeCl3、Al2(SO4)3的混合溶液中逐滴加入Ba(OH)2溶液,形成沉淀的情况如图所示。
氢氧化物
溶液pH
开始沉淀
沉淀完全
沉淀开始溶解
沉淀完全溶解
Fe(OH)3
2.3
3.4
-
-
A1(OH)3
3.3
5.2
7.8
12.8
A. 据图计算原溶液中c(Cl-)>c(SO42-)
B. C点的沉淀为Fe (OH)3
C. AB段可能发生的反应是:2SO42-+ 2Ba2+ + Al3+ + 3OH- == 2BaSO4↓ + A1(OH)3↓
D. OA段可能发生的反应是:3Ba2+ + 6OH- + 3SO42- + Fe3+ + Al3+ = 3BaSO4↓ + Fe (OH)3↓ + A1(OH)3↓
-
科目: 来源: 题型:
查看答案和解析>>【题目】试回答下列中和热测定的有关问题。
(1)实验桌上备有大烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、环形玻璃搅拌棒、0.50mol/L盐酸、0.55mol·L-1NaOH溶液,尚缺少的实验用品是_________。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒______,其原因是_________。
(3)实验时所用盐酸及NaOH溶液的体积均为50mL,各溶液密度为1g/cm3,生成溶液的比热容c=4.18J/(g·℃),实验起始温度为t1℃,终止温度为t2℃。试计算该反应的中和热ΔH=_________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列实验能达到实验目的的是 ( )
A. 在容量瓶中加入一定体积的水,再加入浓硫酸配制准确浓度的稀硫酸
B. 可用四氯化碳萃取出碘水中的碘,但不能用酒精
C. 用玻璃棒搅拌漏斗中的液体以加快过滤速率
D. 加入盐酸以除去硫酸钠中的少量碳酸钠杂质
-
科目: 来源: 题型:
查看答案和解析>>【题目】氢气在氯气中燃烧,正确的是( )
A.火焰呈淡蓝色B.产生大量白烟
C.火焰呈明亮蓝紫色D.火焰呈苍白色且产生白雾
相关试题

