

【题目】下列实验的操作、现象和结论均正确的是
实验操作 | 实验现象 | 实验结论, | |
A | 向FeCl3和 KSCN的混合溶液中滴加NaOH溶液 | 混合溶液颜色逐渐变浅,有红褐色沉淀产生 | Fe3+与SCN-生成Fe(SCN)3是可逆反应 |
B | 将密封有红棕色NO2气体的圆底烧瓶浸入冰水中 | 气体颜色变浅 | 反应2NO2 |
C | 分别向0.1 mol·L- 1的醋酸和饱和硼酸溶液中滴加等浓度的Na2CO3溶液 | 醋酸溶液中有气泡产生,硼酸溶液中无气泡 | 酸性:硼酸>醋酸>碳酸 |
D | 将0.1 mol·L-1AgNO3溶液和0.05mol·L-1NaCl溶液等体积混合,再向混合液中滴入0.05 mol·L-1NaI溶液 | 先产生白色沉淀,后产生黄色沉淀 | Ksp(AgI)<Ksp(AgCl) |
A.AB.BC.CD.D
【答案】A
【解析】
A.Fe3+与SCN-生成Fe(SCN)3是可逆反应,Fe3++3SCN-![]() Fe(SCN)3,向 FeCl3和 KSCN的混合溶液中滴加NaOH溶液,铁离子与氢氧化钠反应生成红褐色氢氧化铁沉淀,使得平衡逆向移动,混合溶液颜色逐渐变浅,故A正确;
Fe(SCN)3,向 FeCl3和 KSCN的混合溶液中滴加NaOH溶液,铁离子与氢氧化钠反应生成红褐色氢氧化铁沉淀,使得平衡逆向移动,混合溶液颜色逐渐变浅,故A正确;
B.将密封有红棕色NO2气体的圆底烧瓶浸入冰水中,气体颜色变浅,说明反应 2NO2![]() N2O4正向移动,则正反应为放热反应,△H<0,故B错误;
N2O4正向移动,则正反应为放热反应,△H<0,故B错误;
C.分别向0.1 mol·L- 1的醋酸和饱和硼酸溶液中滴加等浓度的Na2CO3 溶液,醋酸溶液中有气泡产生,硼酸溶液中无气泡,说明酸性:醋酸>碳酸>硼酸,故C错误;
D.将0.1 mol·L-1AgNO3溶液和0.05mol·L-1NaCl溶液等体积混合,反应后AgNO3过量,再向混合液中滴入0.05 mol·L-1 NaI溶液,反应生成AgI黄色沉淀,不能说明存在沉淀的转化,即不能说明Ksp(AgI)< Ksp(AgCl),故D错误;
故选A。


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:
【题目】“绿水青山就是金山银山”,研究NOx、SO2等大气污染物的妥善处理具有重要意义。
CO 还原NO 的脱硝反应:2CO(g)+2NO(g) 2CO2(g)+N2(g) △H
(1)已知:CO(g)+NO2(g) CO2(g)+NO(g) △H1=-226 kJ·mol-1
N2(g)+2O2(g) 2NO2(g) △H2=+68 kJ·mol-1
N2(g)+O2(g) 2NO(g) △H3=+183 kJ·mol-1
脱硝反应△H=__________,有利于提高NO 平衡转化率的条件是________________(写出两条)。
(2)燃煤发电厂常利用反应2CaCO3(s)+2SO2(g)+O2(g) ![]() 2CaSO4(s)+2CO2(g) ΔH=-681.8kJ·mol-1,对煤进行脱硫处理来减少SO2的排放。对于该反应,在T℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
2CaSO4(s)+2CO2(g) ΔH=-681.8kJ·mol-1,对煤进行脱硫处理来减少SO2的排放。对于该反应,在T℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
时间/min 浓度/mol·L-1 | 0 | 10 | 20 | 30 | 40 | 50 |
O2 | 1.00 | 0.79 | 0.60 | 0.60 | 0.64 | 0.64 |
CO2 | 0 | 0.42 | 0.80 | 0.80 | 0.88 | 0.88 |
①0~10min内,平均反应速率v(CO2)=___mol·L-1·min-1。
②30min后,只改变某一条件,反应重新达到平衡。根据上表中的数据判断,改变的条件可能是________(填字母)。
A.加入一定量的粉状碳酸钙
B.适当缩小容器的体积
C.通入一定量的O2
D.加入合适的催化剂
(3)NOx的排放主要来自于汽车尾气。
有人利用反应C(s)+2NO(g) ![]() N2(g)+CO2(g) ΔH= -34.0kJ·mol-1,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
N2(g)+CO2(g) ΔH= -34.0kJ·mol-1,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
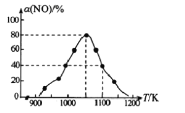
由图可知,1050K前反应中NO的转化率随温度升髙而增大,其原因为______________。
(4)为避免汽车尾气中的有害气体对大气的污染,需给汽车安装尾气净化装置。在净化装置中CO和NO发生反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH=-746.8kJ·mol-1,生成无毒的N2和CO2实验测得,v正=k正c2(NO)·c2(CO),v逆=k逆c(N2) c2(CO2)(k正、k逆为速率常数,只与温度有关)。
N2(g)+2CO2(g) ΔH=-746.8kJ·mol-1,生成无毒的N2和CO2实验测得,v正=k正c2(NO)·c2(CO),v逆=k逆c(N2) c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅降低温度,k正减小的倍数________(填“>”、“<”或“=”)k逆减小的倍数。
②若在1L的密闭容器中充入1molCO和1molNO,在一定温度下达到平衡时,CO的转化率为20%,则![]() =________(计算结果用分数表示)
=________(计算结果用分数表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如下:
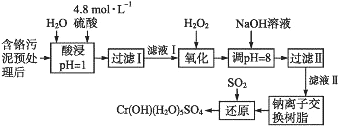
其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)实验室用18.4 mol·L-1的浓硫酸配制240 mL 4.8 mol·L-1的硫酸,需量取浓硫酸__mL;配制时所用玻璃仪器除量筒、烧杯和玻璃棒外,还需____________。
(2)酸浸时,为了提高浸取率可采取的措施有____________________。(答出两点)
(3)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72-,写出此反应的离子方程式_________________。
(4)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀时的ph | 2.7 | — | — | — |
沉淀完全时的ph | 3.7 | 11.1 | 5.4(>8溶解) | 9(>9溶解) |
加入NaOH溶液使溶液呈碱性,Cr2O72-转化为CrO42-。滤液Ⅱ中阳离子主要有_______;但溶液的pH不能超过8,其理由是________________________。
(5)钠离子交换树脂的反应原理为Mn++nNaR→MRn+nNa+,利用钠离子交换树脂除去滤液Ⅱ中的金属阳离子是_____。
(6)写出上述流程中用SO2进行还原时发生反应的化学方程式:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据科技日报网报道南开大学科研团队借助镍和苯基硼酸共催化剂,首次实现丙烯醇高效、绿色合成。丙烯醇及其化合物可合成甘油、医药、农药、香料,合成维生素E和KI及天然抗癌药物紫杉醇中都含有关键的丙烯醇结构。丙烯醇的结构简式为CH2=CH-CH2OH。请回答下列问题:
(1)基态镍原子的电子排布式为___。
(2)1molCH2=CH-CH2OH中σ键和π键的个数比为___,丙烯醇分子中碳原子的杂化类型为___。
(3)丙醛(CH3CH2CHO的沸点为49℃,丙烯醇(CH2=CHCH2OH)的沸点为91℃,二者相对分子质量相等,沸点相差较大的主要原因是___。
(4)羰基镍[Ni(CO)4]用于制备高纯度镍粉,它的熔点为-25℃,沸点为43℃。羰基镍晶体类型是___。
(5)Ni2+能形成多种配离子,如[Ni(NH3)6]2+、[Ni(SCN)3]-和[Ni(CN)2]2-等。[Ni(NH3)6]2+中心原子的配位数是___,与SCN-互为等电子体的分子为___。
(6)“NiO”晶胞如图所示。
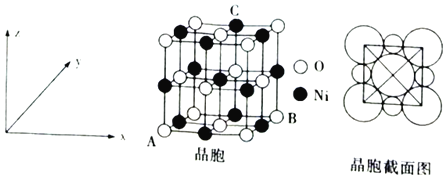
①氧化镍晶胞中原子坐标参数:A(0,0,0)、B(1,1,0),则C原子坐标参数为___。
②已知:氧化镍晶胞密度为dgcm-3,NA代表阿伏加德罗常数的值,则Ni2+半径为___nm(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列给定条件的溶液中, 一定能大量共存的离子组是
A.无色溶液中:K+、Cu2+ 、NO![]() 、Cl-
、Cl-
B.常温下,![]() =0.1的溶液中:Na+、K+、AlO2-、CO
=0.1的溶液中:Na+、K+、AlO2-、CO![]()
C.0. l molL-1的FeCl2溶液中 :K+、SO![]() 、Mg2+、MnO
、Mg2+、MnO![]()
D.Na2S溶液中:SO![]() 、H+、Cl-、Cu2+
、H+、Cl-、Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)键线式![]() 表示的分子式为_________,名称是____________。
表示的分子式为_________,名称是____________。
(2)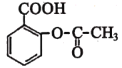 含有的官能团的名称为_____________,写出该物质在酸性环境下水解产物的结构简式__________、__________。
含有的官能团的名称为_____________,写出该物质在酸性环境下水解产物的结构简式__________、__________。
(3)甲醇在铜作催化剂加热时与氧气反应的化学方程式为_________________。
(4)某烷烃B 的结构简式为CH3CH(CH3)CH(C2H5)2, 有一种烷烃C与烷烃B是同分异构体,它却不能由任何烯烃催化加氢得到,则C的结构简式为____________。
(5)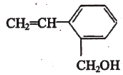 最多______个原子共平面,写出该物质发生加聚反应的化学方程式_________。
最多______个原子共平面,写出该物质发生加聚反应的化学方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.1mol·L-1的H2A溶液中各种微粒浓度的对数值(lgc)与pH的关系如图所示。
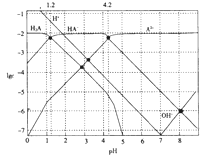
下列说法不正确的是
A. H2A是二元弱酸
B. HA-![]() H++A2-的电离平衡常数Ka=10-12
H++A2-的电离平衡常数Ka=10-12
C. 0.1mol·L-1的H2A溶液中:c(H+)=c(HA-)+2c(A2-)+c(OH-)
D. pH=4.2 时:c(HA-)=c(A2-)>c(H+)>c(H2A)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以玉米(主要成分是淀粉)为原料制备乙醇的流程如下:

下列说法中不正确的是
A. C12H22O11属于二糖B. 可采取分液的方法分离乙醇和水
C. 可用碘水检验淀粉是否完全水解D. 葡萄糖可以在酒曲酶作用下分解生成乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香族化合物C的分子式为C9H9OCl。C分子中有一个甲基且苯环上只有一条侧链;一定条件下C能发生银镜反应;C与其他物质之间的转化如图所示:
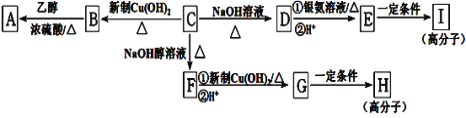
(1)C的结构简式是_____。
(2)E中含氧官能团的名称是______;C→F的反应类型是_____。
(3)写出下列化学方程式:G在一定条件下合成H的反应______。
(4)D的一种同系物W(分子式为C8H8O2)有多种同分异构体,则符合以下条件W的同分异构体有_____种,写出其中核磁共振氢谱有4个吸收峰的结构简式_____。
①属于芳香族化合物
②遇FeCl3溶液不变紫色
③能与NaOH溶液发生反应但不属于水解反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com