
【题目】据科技日报网报道南开大学科研团队借助镍和苯基硼酸共催化剂,首次实现丙烯醇高效、绿色合成。丙烯醇及其化合物可合成甘油、医药、农药、香料,合成维生素E和KI及天然抗癌药物紫杉醇中都含有关键的丙烯醇结构。丙烯醇的结构简式为CH2=CH-CH2OH。请回答下列问题:
(1)基态镍原子的电子排布式为___。
(2)1molCH2=CH-CH2OH中σ键和π键的个数比为___,丙烯醇分子中碳原子的杂化类型为___。
(3)丙醛(CH3CH2CHO的沸点为49℃,丙烯醇(CH2=CHCH2OH)的沸点为91℃,二者相对分子质量相等,沸点相差较大的主要原因是___。
(4)羰基镍[Ni(CO)4]用于制备高纯度镍粉,它的熔点为-25℃,沸点为43℃。羰基镍晶体类型是___。
(5)Ni2+能形成多种配离子,如[Ni(NH3)6]2+、[Ni(SCN)3]-和[Ni(CN)2]2-等。[Ni(NH3)6]2+中心原子的配位数是___,与SCN-互为等电子体的分子为___。
(6)“NiO”晶胞如图所示。
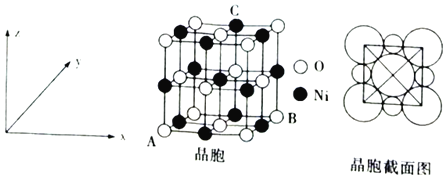
①氧化镍晶胞中原子坐标参数:A(0,0,0)、B(1,1,0),则C原子坐标参数为___。
②已知:氧化镍晶胞密度为dgcm-3,NA代表阿伏加德罗常数的值,则Ni2+半径为___nm(用代数式表示)。
【答案】[Ar]3d84s2 9:1 sp3、sp2 丙烯醇分子间存在氢键 分子晶体 6 CO2等 (![]() ,1,1)
,1,1) ![]() ×3
×3![]() ×107
×107
【解析】
(1)基态镍原子核外有28个电子,根据构造原理书写Ni原子核外电子排布式;
(2)共价单键为σ键,共价双键中含有1个σ键、1个π键,则1个CH2=CH-CH2OH中含有9个σ键、1个π键;丙烯醇分子中连接羟基的C原子价层电子对个数是4、连接碳碳双键两端的碳原子价层电子对个数是3,根据价层电子对互斥理论判断碳原子的杂化类型;
(3)含有分子间氢键的物质熔沸点较高;
(4)分子晶体熔沸点较低;
(5)[Ni(NH3)6]2+中心原子的配位数是6,与SCN-互为等电子体的分子中含有3个原子、价电子数是16;
(6)①氧化镍晶胞中原子坐标参数:A(0,0,0)、B(1,1,0),C原子在x、y、z轴分别为![]() 、1、1;
、1、1;
②利用均摊法求出晶胞中氧离子个数和镍离子个数,再根据![]() 反求晶胞参数,根据截面图找到离子半径和晶胞参数的关系进行求解。
反求晶胞参数,根据截面图找到离子半径和晶胞参数的关系进行求解。
![]() 基态镍原子核外有28个电子,根据构造原理书写Ni原子核外电子排布式
基态镍原子核外有28个电子,根据构造原理书写Ni原子核外电子排布式![]() ,故答案为:
,故答案为:![]() ;
;
![]() 共价单键为
共价单键为![]() 键,共价双键中含有1个
键,共价双键中含有1个![]() 键、1个
键、1个![]() 键,则1个
键,则1个![]() 中含有9个
中含有9个![]() 键、1个
键、1个![]() 键,1mol
键,1mol![]() 中
中![]() 键和
键和![]() 键的个数比为9mol:
键的个数比为9mol:![]() :1;丙烯醇分子中连接羟基的C原子价层电子对个数是4、连接碳碳双键两端的碳原子价层电子对个数是3,根据价层电子对互斥理论判断碳原子的杂化类型,前者为
:1;丙烯醇分子中连接羟基的C原子价层电子对个数是4、连接碳碳双键两端的碳原子价层电子对个数是3,根据价层电子对互斥理论判断碳原子的杂化类型,前者为![]() 、后者为
、后者为![]() ,故答案为:9:1;
,故答案为:9:1;![]() 、
、![]() ;
;
![]() 含有分子间氢键的物质熔沸点较高,丙烯醇分子间存在氢键导致其熔沸点较高,故答案为:丙烯醇分子间存在氢键;
含有分子间氢键的物质熔沸点较高,丙烯醇分子间存在氢键导致其熔沸点较高,故答案为:丙烯醇分子间存在氢键;
![]() 分子晶体熔沸点较低,该晶体熔沸点较低,为分子晶体,故答案为:分子晶体;
分子晶体熔沸点较低,该晶体熔沸点较低,为分子晶体,故答案为:分子晶体;
![]() 中心原子的配位数是6,与
中心原子的配位数是6,与![]() 互为等电子体的分子中含有3个原子、价电子数是16,其等电子体分子有
互为等电子体的分子中含有3个原子、价电子数是16,其等电子体分子有![]() 等,故答案为:6;
等,故答案为:6;![]() 等;
等;
![]() 氧化镍晶胞中原子坐标参数:
氧化镍晶胞中原子坐标参数:![]() 0,
0,![]() 、
、![]() 1,
1,![]() ,C原子在x、y、z轴分别为
,C原子在x、y、z轴分别为![]() 、1、1,则C点晶胞参数为
、1、1,则C点晶胞参数为![]() 、1、
、1、![]() ,故答案为:
,故答案为:![]() 、1、
、1、![]() ;
;
![]() 该晶胞中,氧离子个数
该晶胞中,氧离子个数![]() 、镍离子个数
、镍离子个数![]() ,
,
氧化镍晶胞密度为![]() ,
,![]() 代表阿伏加德罗常数的值,晶胞体积
代表阿伏加德罗常数的值,晶胞体积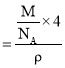 ,晶胞棱长
,晶胞棱长![]() ,截面对角线长度
,截面对角线长度![]() ,
,![]() 半径为
半径为![]() ,镍离子半径
,镍离子半径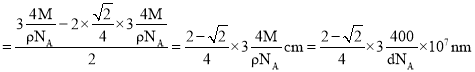 ,故答案为:
,故答案为:![]() 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某兴趣小组在实验室用乙醇、浓硫酸和溴化钠和水混合反应来制备溴乙烷,并探究溴乙烷的性质。有关数据见下表:
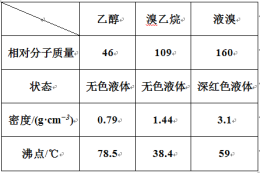
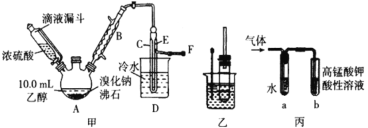
I. 溴乙烷的制备
反应原理如下,实验装置如上图(加热装置、夹持装置均省略):
H2SO4+NaBr ![]() NaHSO4+HBr↑ CH3CH2OH+HBr
NaHSO4+HBr↑ CH3CH2OH+HBr ![]() CH3CH2Br+H2O
CH3CH2Br+H2O
(1) 图甲中A 仪器的名称_____,图中B 冷凝管的作用为_____。
(2) 若图甲中A 加热温度过高或浓硫酸的浓度过大,均会使 C 中收集到的粗产品呈橙色,原因是A 中发生了副反应生成了_____;F 连接导管通入稀NaOH 溶液中,其目的主要是吸收_____等尾气防止污染空气
II. 溴乙烷性质的探究
用如图实验装置验证溴乙烷的性质:
(3) 在乙中试管内加入 10mL6mol·L -1NaOH 溶液和 2mL 溴乙烷,振荡、静置,液体分层,水浴加热。该过程中的化学方程式为_______。
(4) 若将乙中试管里的 NaOH 溶液换成NaOH 乙醇溶液,为证明产物为乙烯,将生成的气体通入如图丙装置。a 试管中的水的作用是_______;若无 a 试管,将生成的气体直接通入 b 试管中,则 b中的试剂可以为 _____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.100mol/L的NaOH溶液分别滴定20.00mL0.100mol/L的盐酸和0.100mol/L的醋酸,得到两条滴定曲线,如图所示:
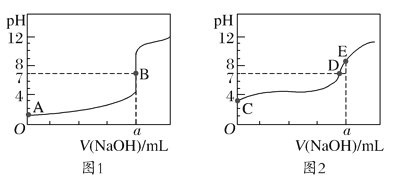
下列说法正确的是( )
A.滴定盐酸的曲线是图2
B.两次滴定均可选择甲基橙或酚酞作指示剂
C.达到B、E点时,反应消耗的n(CH3COOH)=n(HCl)
D.以HA表示酸,当0mL<V(NaOH)<20.00mL时,图2对应混合液中各离子浓度由大到小的顺序一定是c(A-)>c(Na+)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】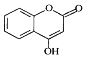 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成。
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成。
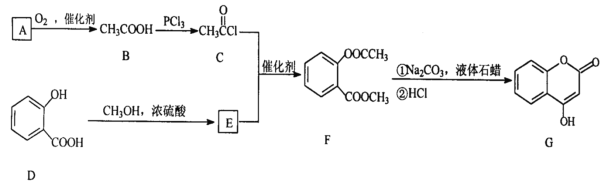
请回答下列问题:
(1)A与银氨溶液反应有银镜生成,则A的结构简式是__________________
(2)B→C的反应类型是______________
(3)写出F和过量NaOH溶液共热时反应的化学方程_______________________________
(4)下列关于G的说法正确的是______________
a.能与溴单质反应
b.能与金属钠反应
c.1molG最多能和3mol氢气反应
d.分子式是C9H7O3
(5)与D互为同分异构体且含有酚羟基、酯基的有_____________种
(6)根据已学知识和获取的信息,写出以CH3COOH,![]() 为原料合成重要的化工产品
为原料合成重要的化工产品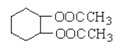 的路线流程图__________________________(无机试剂任选)合成路线流程图示例如下:CH3CH2OH
的路线流程图__________________________(无机试剂任选)合成路线流程图示例如下:CH3CH2OH![]() CH2=CH2
CH2=CH2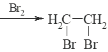
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】柠檬烯![]()
![]()
![]() 具有良好的镇咳、祛痰、抑菌作用。下列关于柠檬烯的说法正确的是( )
具有良好的镇咳、祛痰、抑菌作用。下列关于柠檬烯的说法正确的是( )
A.能使酸性高锰酸钾溶液褪色,其褪色原理与![]() 相同
相同
B.能发生氧化反应、加成反应、取代反应、缩聚反应
C.与乙烯互为同系物,其一氯代物有8种
D.分子中所有碳原子可能处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中错误的是
A.从CH4、NH4+、SO42-为正四面体结构,可推测PH4+、PO43-也为正四面体结构
B.1mol金刚石晶体中,平均含有2molC—C键
C.构成单质分子的微粒之间不一定存在共价键
D.某气态团簇分子结构如图所示,该分子的分子式为EF或FE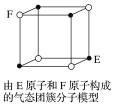
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图所示,下列有关该有机物的说法中正确的是( )
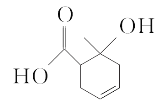
A.能和碳酸氢钠溶液反应的官能团有2种
B.1 mol该有机物最多能与2 mol H2发生加成反应
C.与![]() 互为同分异构体
互为同分异构体
D.既可以发生取代反应又可以发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y两根金属棒插入Z溶液中构成如图的装置,实验中电流表指针发生偏转,同时X棒变粗,Y棒变细,则X、Y、Z可能是( )
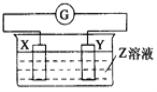
选项 | X | Y | Z |
A | Zn | Cu | 稀硫酸 |
B | Cu | Zn | 稀硫酸 |
C | Cu | Ag | 硫酸铜溶液 |
D | Ag | Zn | 硝酸银溶液 |
A.AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制汞的过程是:焙烧辰砂(主要含HgS),发生反应:HgS+O2![]() Hg+SO2还原出的汞呈气态,冷凝得液态汞。其流程如图,下列说法不正确的是
Hg+SO2还原出的汞呈气态,冷凝得液态汞。其流程如图,下列说法不正确的是
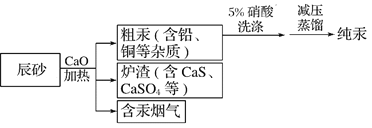
A. 洗涤粗汞时可用5%的盐酸代替5%的硝酸
B. HgS+O2![]() Hg+SO2属于置换反应
Hg+SO2属于置换反应
C. 含汞烟气必须处理达标后才能排放
D. 流程中加入氧化钙的目的是减少SO2的排放
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com