【题目】BE是现代有机化工重要的单体之一,工业上采取乙苯催化脱氢制苯乙烯反应制备:
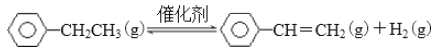
(1)已知:
化学键 | C-H | C-C | C=C | H-H |
键能/ | 412 | 348 | 612 | 436 |
计算上述反应的![]() _______
_______![]() 。该反应能够发生的原因是______
。该反应能够发生的原因是______
(2)维持体系总压强p恒定,在温度T时,物质的量为n、体积为V的乙苯蒸汽发生催化脱氢反应。已知乙苯的平衡转化率为![]() ,则在该温度下反应的平衡常数K=_______(用a等符号表示)。
,则在该温度下反应的平衡常数K=_______(用a等符号表示)。
(3)工业上,通常在乙苯蒸气中掺混水蒸气,控制反应温度600℃,并保持体系总压为常压的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了![]() 以外的产物中苯乙烯的物质的量分数)示意图如图所示:
以外的产物中苯乙烯的物质的量分数)示意图如图所示:
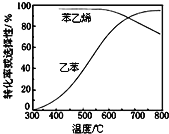
a.掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实__________。
b.控制反应温度为![]() 的理由是___________
的理由是___________
(4)在逆过程苯乙烯加氢制乙苯的操作中,如果氢气中混有![]() 和
和![]() 等杂质,会引起催化剂中毒,因此必须除去。在常温下,可以用银氨溶液来检测微量的
等杂质,会引起催化剂中毒,因此必须除去。在常温下,可以用银氨溶液来检测微量的![]() ,其原理与银镜反应相似,有银析出,写出银氨溶液与
,其原理与银镜反应相似,有银析出,写出银氨溶液与![]() 反应的离子方程式________________。
反应的离子方程式________________。
(5)苯乙烯废气在工业上常用电催化氧化处理,原理如图所示:
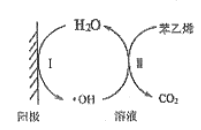
写出阳极电极反应式I为______________
参考答案:
【答案】+124 ![]()
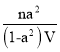 正反应气体分子数增加,水蒸气起稀释作用,相当于减压的效果 600℃,乙苯的转化率和苯乙烯的选择性均较高 2[Ag(NH3)2]OH+CO=(NH4)2CO3+2Ag↓+2NH3 H2O-e-=-OH+H+
正反应气体分子数增加,水蒸气起稀释作用,相当于减压的效果 600℃,乙苯的转化率和苯乙烯的选择性均较高 2[Ag(NH3)2]OH+CO=(NH4)2CO3+2Ag↓+2NH3 H2O-e-=-OH+H+
【解析】
(1)反应热=反应物总键能-生成物总能键能,由有机物的结构可知,应是-CH2CH3中总键能与-CH=CH2、H2总键能之差;该反应能够发生的原因是△H-T△S<0;
(2)用三行式分析各物质的平衡值,再根据平衡常数表达式K=c(苯乙酸)×c(H2)/c(乙苯)计算;
(3)a.保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向气体体积增大的方向移动;
b.600℃时乙苯的转化率与苯乙烯的选择性均较高;结合温度对乙苯转化率、苯乙烯选择性、温度对反应速率与催化剂的影响及消耗能量等,分析控制反应温度为600℃的理由;
(4)银氨溶液将CO氧化,生成银和碳酸根;
(5)由图I为阳极水失电子被氧化生成羟基和氢离子;
(1)反应热=反应物总键能-生成物总能键能,由有机物的结构可知,应是-CH2CH3中总键能与-CH=CH2、H2总键能之差,故△H=(5×412+348-3×412-612-436)kJ·mol-1=+124kJ·mol-1;
该反应能够发生的原因是△H-T△S<0,现△H>0,故△S>0;
(2)物质的量为n、体积为V的乙苯蒸气发生催化脱氢反应参加反应的乙苯为nα mol,则:
![]()
![]()
![]() +H2
+H2
开始(mol):n 0 0
转化(mol):nα nα nα
平衡(mol):n(1-α) nα nα
维持体系总压强p恒定,在温度T时,由PV=nRT可知,混合气体总浓度不变,设反应后的体积为V′,则
[n(1-α)+nα+nα]/V′=n/V,故V′=(1+α)V,则平衡常数K=c(苯乙酸)×c(H2)/c(乙苯),则K= ;
;
(3)a.正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动,提高乙苯的平衡转化率,
b.600℃时乙苯的转化率与苯乙烯的选择性均较高,温度过低,反应速率较慢,转化率较低,温度过高,选择性下降,高温下可能使催化剂失去活性,且消耗能量较大,故选择600℃左右;
(4)银氨溶液将CO氧化,生成银和碳酸根,银氨溶液与![]() 反应的离子方程式2[Ag(NH3)2]OH+CO=(NH4)2CO3+2Ag↓+2NH3;
反应的离子方程式2[Ag(NH3)2]OH+CO=(NH4)2CO3+2Ag↓+2NH3;
(5)由图I为阳极水失电子被氧化生成羟基和氢离子:H2O-e-=-OH+H+。
-
科目: 来源: 题型:
查看答案和解析>>【题目】 N2(g)与H2(g)在铁催化剂表面经历如下过程生成NH3(g),则下列说法正确的是

A.Ⅰ中破坏的均为极性键
B.Ⅳ中NH2与H2生成NH3
C.Ⅱ、Ⅲ、Ⅳ均为放热过程
D.N2(g)+3H2(g)
 2NH3(g)1mol氮气完全反应放热44kJ
2NH3(g)1mol氮气完全反应放热44kJ -
科目: 来源: 题型:
查看答案和解析>>【题目】下列说法不正确的是
A.涤纶属于合成纤维
B.用Cu(OH)2悬浊液可以鉴别乙醇、乙酸溶液、葡萄糖溶液
C.石油的分馏、煤的液化和气化、煤的干馏都是物理变化,石油的裂化、裂解都是化学变化
D.制取环氧乙烷:2CH2=CH2+O2
 2
2 ,符合绿色化学的理念
,符合绿色化学的理念 -
科目: 来源: 题型:
查看答案和解析>>【题目】马来酸酐(顺-丁烯二酸肝)
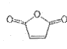 是一种重要的化工原料,可用于合成可降解的高聚物PES树脂以及具有抗肿瘤活性的化合物K。
是一种重要的化工原料,可用于合成可降解的高聚物PES树脂以及具有抗肿瘤活性的化合物K。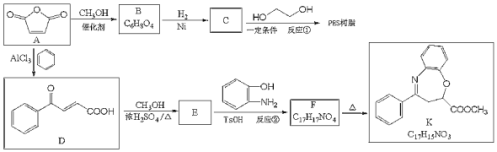
己知:
I.
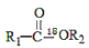 +
+
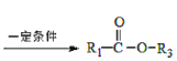 +
+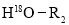
II.
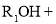
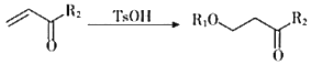
III.
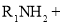
 +H2O(
+H2O(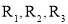 代表烃基)
代表烃基)回答下列问题:
(1)C的名称是__________,反应②的反应类型是_______
(Q)B的顺式结构简式为_________,F含氧官能团的结构简式__________。
(3)反应①的化学方程式为_______________。
(4)C有多种同分异构体,其中与C具有完全相同的官能团,且核磁共振氢谱只有两个峰的同分异构体的结构简式为__________(不考虑立体异构)。
(5)己知:氨基(
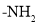 )与羟基类似,也能发生反应I。在由F制备K的过程中,常会产生副产物L,L分子式为
)与羟基类似,也能发生反应I。在由F制备K的过程中,常会产生副产物L,L分子式为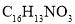 ,含三个六元环,则L的结构简式为________。
,含三个六元环,则L的结构简式为________。(6)写出由B合成酒石酸
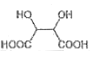 (的合成路线:_______________________。
(的合成路线:_______________________。 -
科目: 来源: 题型:
查看答案和解析>>【题目】可逆反应2NO2
 2NO+O2在密闭容器中反应,达到平衡状态的标志是
2NO+O2在密闭容器中反应,达到平衡状态的标志是①单位时间内生成nmolO2的同时生成2nmolNO2
②单位时间内生成nmolO2的同时生成2nmolNO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
⑤密闭恒容条件下,气体密度不变
⑥密闭恒容条件下,混气平均相对分子质量不变
A.①③④⑤B.②③C.①④⑥D.①②④⑥
-
科目: 来源: 题型:
查看答案和解析>>【题目】实验室常用
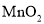 与浓盐酸反应制备
与浓盐酸反应制备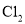 。
。(1)制备反应会因盐酸浓度下降面停止。为测定反应残余液中盐酸的浓度,探究小组同学提出下列实验方案:
甲方案:与足量
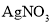 溶液反应,称量生成的
溶液反应,称量生成的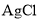 质量。
质量。乙方案:采用酸碱中和滴定法测定。
丙方案:与己知量
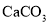 (过量)反应,称量剩余的
(过量)反应,称量剩余的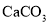 质量。
质量。丁方案:与足量
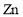 反应,测量生成的
反应,测量生成的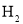 体积。
体积。继而进行下列判断和实验:
①判定甲方案不可行。现由是_________。
②进行乙方案实验;准确量取残余清液稀释一定倍数后作为试样。
a.量取试样
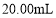 ,用
,用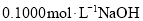 标准溶液滴定,选择的指示剂是____,消耗
标准溶液滴定,选择的指示剂是____,消耗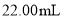 ,该次滴定测得试样中盐酸浓度为_______
,该次滴定测得试样中盐酸浓度为_______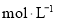
b._________,获得实验结果。
③判断两方案的实验结果________(填“偏大”、“偏小”或“准确”).
[已知:
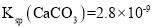 、
、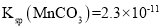 ]
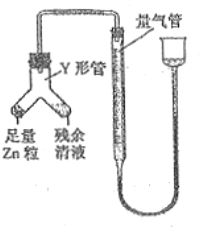
]④进行丁方案实验:装置如图所示(夹持器具已略去)。
a.使Y形管中的残余清液与锌粒反应的正确操作是将_______转移到____中。
b.反应完毕,每间隔1分钟读取气体体积,气体体积逐次减小,直至不变。气体体积逐次减小的原因是__________(排除仪器和实验操作的影响因素),至体积不变时,量气管的左侧液面高于右侧液面,此时读数测得的体积__________(填“偏大”、“偏小”或“准确”)
(2)若没有酒精灯,也可以采用
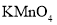 与浓盐酸反应制取适量氯气的如下简易装置。
与浓盐酸反应制取适量氯气的如下简易装置。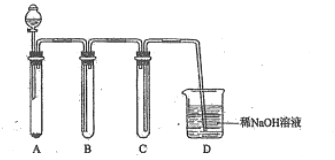
装置B、C、D的作用分别是:
B___________C______________D______________
-
科目: 来源: 题型:
查看答案和解析>>【题目】为确定试样xNa2CO3·yNaHCO3的组成,某同学将质量为a g的试样加水溶解后,所得试样溶液进行如下实验:

注:NaHCO3溶液pH约为8.3,饱和H2CO3溶液pH约为4.0。
下列说法正确的是
A. 当pH=8.3时,溶液中只存在Na+、H+、HCO3-、Cl-、OH-
B. 溶液pH由8.3变为4.0过程中,发生反应:CO32- +2H+ =CO2↑+H2O
C. 若V2=2V1,则x=y
D. 试样中,NaHCO3的质量分数=[(8.4×10-3V2)/a]×100%
相关试题

