【题目】 N2(g)与H2(g)在铁催化剂表面经历如下过程生成NH3(g),则下列说法正确的是

A.Ⅰ中破坏的均为极性键
B.Ⅳ中NH2与H2生成NH3
C.Ⅱ、Ⅲ、Ⅳ均为放热过程
D.N2(g)+3H2(g)![]() 2NH3(g)1mol氮气完全反应放热44kJ
2NH3(g)1mol氮气完全反应放热44kJ
参考答案:
【答案】C
【解析】
A.氮气和氢气中只含非极性共价键,则I中破坏只有非极性键,故A错误;
B.Ⅲ结合生成NH2,可知Ⅳ中NH2与H生成NH3,故B错误;
C.Ⅱ、Ⅲ、Ⅳ均为成键过程,形成化学键释放能量,则均为放热过程,故C正确;
D.由图可知,0.5molN2反应生成NH3,![]() =1129(324+389+460)=44 kJ/mol,则N2(g)+3H2(g) 2NH3(g)
=1129(324+389+460)=44 kJ/mol,则N2(g)+3H2(g) 2NH3(g) ![]() =88kJ/mol,故D错误;
=88kJ/mol,故D错误;![]()
答案选C。
-
科目: 来源: 题型:
查看答案和解析>>【题目】
 ,改变
,改变 溶液的
溶液的 ,溶液中
,溶液中 浓度的对数值
浓度的对数值 与溶液
与溶液 的变化关系如图所示。若
的变化关系如图所示。若 。下列叙述错误的是( )
。下列叙述错误的是( )
A.
 时,
时,
B.
 电离常数的数量级为
电离常数的数量级为
C. 图中点x的纵坐标值为

D.
 的
的 约等于线c与线d交点处的横坐标值
约等于线c与线d交点处的横坐标值 -
科目: 来源: 题型:
查看答案和解析>>【题目】为将含有的FeCl3、FeCl2、CuCl2的废液中的Cu2+还原回收,某同学在含有ag铁粉的容器中加入废液,探究了加入废液体积与完全反应后体系中固体质量的关系,部分实验数据如下表所示。已知:废液中c(Cu2+)=0.7 mol·Lˉ1;废液体积大于0.5L,充分反应后才能检测出Cu2+。

下列说法不正确的是
A. 当铁粉与0.25L废液反应完全后,固体成分为Fe与Cu
B. 当铁粉与1L废液反应完全后,再加入废液时发生的离子反应为Fe +2Fe3+=3Fe2+
C. 废液中c(Fe3+)=0.2 mol·Lˉ1
D. 要将1L废液中的Cu2+全部还原,则至少需要铁粉44.8g
-
科目: 来源: 题型:
查看答案和解析>>【题目】过氧化氢(H2O2)溶液俗称双氧水,医疗上常用3%的双氧水进行伤口消毒。H2O2能与SO2反应生成H2SO4, H2O2的分子结构如图所示。下列说法错误的是( )

A. H2O2的结构式为H—O—O—H
B. H2O2为含有极性键和非极性键的共价化合物
C. 与SO2在水溶液中反应的离子方程式为SO2+ H2O2=2H++SO42-
D. H2O2与SO2反应过程中有共价键断裂,同时有共价键和离子键形成
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列说法不正确的是
A.涤纶属于合成纤维
B.用Cu(OH)2悬浊液可以鉴别乙醇、乙酸溶液、葡萄糖溶液
C.石油的分馏、煤的液化和气化、煤的干馏都是物理变化,石油的裂化、裂解都是化学变化
D.制取环氧乙烷:2CH2=CH2+O2
 2
2 ,符合绿色化学的理念
,符合绿色化学的理念 -
科目: 来源: 题型:
查看答案和解析>>【题目】马来酸酐(顺-丁烯二酸肝)
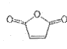 是一种重要的化工原料,可用于合成可降解的高聚物PES树脂以及具有抗肿瘤活性的化合物K。
是一种重要的化工原料,可用于合成可降解的高聚物PES树脂以及具有抗肿瘤活性的化合物K。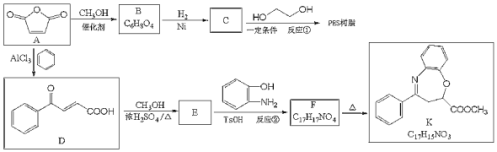
己知:
I.
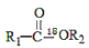 +
+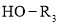
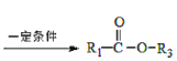 +
+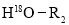
II.
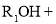
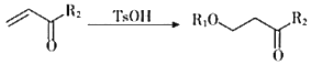
III.
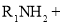
 +H2O(
+H2O( 代表烃基)
代表烃基)回答下列问题:
(1)C的名称是__________,反应②的反应类型是_______
(Q)B的顺式结构简式为_________,F含氧官能团的结构简式__________。
(3)反应①的化学方程式为_______________。
(4)C有多种同分异构体,其中与C具有完全相同的官能团,且核磁共振氢谱只有两个峰的同分异构体的结构简式为__________(不考虑立体异构)。
(5)己知:氨基(
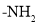 )与羟基类似,也能发生反应I。在由F制备K的过程中,常会产生副产物L,L分子式为
)与羟基类似,也能发生反应I。在由F制备K的过程中,常会产生副产物L,L分子式为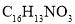 ,含三个六元环,则L的结构简式为________。
,含三个六元环,则L的结构简式为________。(6)写出由B合成酒石酸
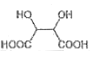 (的合成路线:_______________________。
(的合成路线:_______________________。 -
科目: 来源: 题型:
查看答案和解析>>【题目】BE是现代有机化工重要的单体之一,工业上采取乙苯催化脱氢制苯乙烯反应制备:
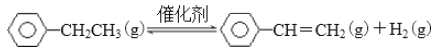
(1)已知:
化学键
C-H
C-C
C=C
H-H
键能/
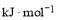
412
348
612
436
计算上述反应的
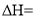 _______
_______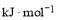 。该反应能够发生的原因是______
。该反应能够发生的原因是______(2)维持体系总压强p恒定,在温度T时,物质的量为n、体积为V的乙苯蒸汽发生催化脱氢反应。已知乙苯的平衡转化率为
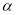 ,则在该温度下反应的平衡常数K=_______(用a等符号表示)。
,则在该温度下反应的平衡常数K=_______(用a等符号表示)。(3)工业上,通常在乙苯蒸气中掺混水蒸气,控制反应温度600℃,并保持体系总压为常压的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了
 以外的产物中苯乙烯的物质的量分数)示意图如图所示:
以外的产物中苯乙烯的物质的量分数)示意图如图所示: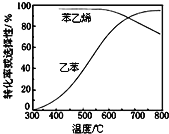
a.掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实__________。
b.控制反应温度为
 的理由是___________
的理由是___________(4)在逆过程苯乙烯加氢制乙苯的操作中,如果氢气中混有
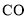 和
和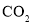 等杂质,会引起催化剂中毒,因此必须除去。在常温下,可以用银氨溶液来检测微量的
等杂质,会引起催化剂中毒,因此必须除去。在常温下,可以用银氨溶液来检测微量的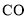 ,其原理与银镜反应相似,有银析出,写出银氨溶液与
,其原理与银镜反应相似,有银析出,写出银氨溶液与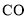 反应的离子方程式________________。
反应的离子方程式________________。(5)苯乙烯废气在工业上常用电催化氧化处理,原理如图所示:
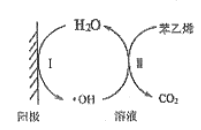
写出阳极电极反应式I为______________
相关试题

