【题目】X、Y、Z三种元素的离子都和氩原子具有相同的电子层排布。X元素单质能在氢气中燃烧,产生苍白色火焰;Y元素氢化物的分子式是H2Y,其最高氧化物含有40%的Y;Z元素的离子具有紫色的焰色反应。
(1)根据以上条件,推断元素名称:X:_____,Y:_____,Z:________。
(2)X、Y、Z最高价氧化物对应的水化物的酸性由强到弱的顺序是________。
(3)用电子式表示Z2Y的形成过程:___________,其化合物中化学键的类型是________。
参考答案:
【答案】C
【解析】试题分析:X、Y、Z三种元素的离子都和氩原子具有相同的电子层排布,X元素的单质能在氢气中燃烧,产生苍白色火焰,则X为Cl元素;Y元素氢化物的分子是H2Y,则Y的最高化合价是+6价,其最高价氧化物含有40%的Y,最高价氧化物为YO3,令Y的相对原子质量为a,则A÷(a×48)=40%,解得a=32,故Y为S元素;Z元素的离子具有紫色的焰色反应,说明Z是钾元素。(1)由上述分析可知,X是氯;Y为硫,Z为钾;(2)X、Y、Z最高价氧化物对应的水化物分别是HClO4、H2SO4、KOH。非金属性Cl>S,故酸性HClO4>H2SO4,KOH属于碱,故酸性由强到弱的顺序是:HClO4>H2SO4>KOH;(3)K2S属于离子化合物,用K、S原子的电子式表示其形成过程:![]() ,化合物中化学键的类型是离子键。
,化合物中化学键的类型是离子键。
-
科目: 来源: 题型:
查看答案和解析>>【题目】A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和。
(1)A为 ,B为 ,C为 。D的最高价氧化物的水化物是 。
(2)写出A、B的化合物与E反应的化学方程式: 。
(3)A、B两元素形成化合物属 (填“离子”或“共价”)化合物。
(4)写出D的最高价氧化物的水化物和A反应的化学方程式: 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】无水三氯化铁易升华,有强烈的吸水性,是一种用途比较广泛的盐。
(1)实验室中可将FeCl3溶液 、 、过滤、洗涤干燥得FeCl3·6H2O;再 ,得到无水FeCl3。
(2)室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH为2.7时,Fe3+开始沉淀;当溶液pH为4时,c(Fe3+)= mol·L-1(已知:Ksp[Fe(OH)3]= 1.1×10-36)。
(3)利用工业FeCl3制取纯净的草酸铁晶体[Fe2(C2O4)3·5H2O]的实验流程如下图所示:
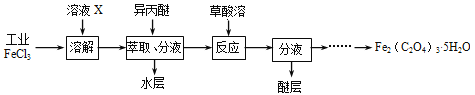
①为抑制FeCl3水解,溶液X为 。
②上述流程中FeCl3能被异丙醚萃取,其原因是 ;检验萃取、分液后所得水层中是否含有Fe3+的方法是 。
③所得Fe2(C2O4)3·5H2O需用冰水洗涤,其目的是 。
④为测定所得草酸铁晶体的纯度,实验室称取a g样品,加硫酸酸化,用KMnO4标准溶液滴定生成的H2C2O4,KMnO4标准溶液应置于右图所示仪器 (填“甲”或“乙”)中;下列情况会造成实验测得Fe2(C2O4)3·5H2O含量偏低的是 。
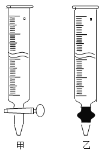
a.盛放KMnO4的滴定管水洗后未用标准液润洗
b.滴定管滴定前尖嘴部分有气泡,滴定后消失
c.滴定前仰视读数,滴定后俯视读数
-
科目: 来源: 题型:
查看答案和解析>>【题目】下表是稀硫酸与某金属反应的实验数据:

分析上述数据,回答下列问题:
(1) 实验4和5表明_________对反应速率有影响;________,反应速率越快,能表明这一规
律另一组实验是___________(填实验序号)。
(2) 在前4次实验中,能表明反应物浓度对反应速率产生影响的实验有____(填序号)。
(3) 本实验中影响反应速率的其他因素还有_________,其实验序号是_____。
(4) 实验中,反应前后溶液的温度变化值(约15℃)相近,推测其原因:
_________________________________________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某同学想通过比较两种最高价氧化物的水化物的酸性强弱来验证硫与碳的非金属性强弱,它采用了如图所示的装置进行试验。请回答:
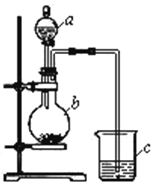
(1)仪器a的名称是____________,应盛放下列药品中的_______。
A.稀硫酸 B.亚硫酸 C.氢硫酸 D.盐酸
(2)仪器b的名称是____________,应盛放下列药品中的______。
A.碳酸钙 B.硫酸钠 C.氯化钠 D.碳酸钠
(3)仪器c中应盛放的药品是____________,如果看到的现象是____________________,证明b中反应产生了_____________________,即可证明__________比_________酸性强,非金属性__________比__________强,b中发生反应的离子方程式为__________________________________________
-
科目: 来源: 题型:
查看答案和解析>>【题目】按要求写出:
(1)一核10电子的阳离子的符号_________;
(2)两核10电子的阴离子的电子式___________;
(3)三核10电子的共价化合物的电子式_______;
(4)四核10电子的阳离子的电子式:__________;
(5)四核10电子的共价化合物的结构式_________;
(6)五核10电子的阳离子的化学式___________;
(7)五核10电子的共价化合物的结构式___________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】计算多元弱酸(HnX)溶液的c(H+)及比较弱酸的相对强弱时,通常只考虑第一步电离。回答下列关于多元弱酸HnX的问题。
(1)若要使HnX溶液中c(H+)/c(HnX)增大,可以采取的措施是__________。
A.升高温度 B.加少量固态HnX C.加少量NaOH溶液 D.加水
(2)用离子方程式解释NanX呈碱性的原因:______________________________。
(3)若HnX为H2C2O4,且某温度下,H2C2O4的K1=5×10-2、K2=5×10-5.则该温度下,0.2mol/L H2C2O4溶液中c(H+)约为__________mol/L。(精确计算,且己知
 )
)(4)已知KHC2O4溶液呈酸性。
①KHC2O4溶液中,各离子浓度由大到小的顺序是____________________。
②在KHC2O4溶液中,各粒子浓度关系正确的是__________。
A.c(C2O42-)<c(H2C2O4)
B.c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4)
C.c(K+)+c(H+)=c(OH-)+c(HC2O42-)+2c(C2O42-)
D.c(K+)=c(C2O42-)+c(HC2O4-)+c(H2C2O4)
相关试题

