【题目】元素X位于第四周期,其基态原子有4个未成对电子。Y原子最外层电子数是其内层电子总数的3倍,元素Z基态原子的3p轨道上有4个电子,W原子的2p轨道上有3个未成对电子。
(1)Y与W、Z可形成多种化合物。
①元素Y与Z中电负性较大的是_________________(用元素符号描述)。
②离子ZY32-的空间构型为_______________ (用文字描述),杂化方式______________。
③ZY2空间构型_________,杂化方式________,分子的极性________(填“极性”或“非极性”)。
④元素Y与W中第一电离能较大的是___________________(用元素符号描述)。
(2)Y的氢化物(H2Y)在乙醇中的溶解度大于H2Z,其原因是_____________。
(3)含X2+的溶液与KCN、氨水反应可得到化合物K3[X(CN)5(NH3)]。
①基态X2+的电子排布式是________________。
②1 mol配合物K3[X(CN)5(NH3)]中含σ键的数目为___________。
③画出X原子的价电子排布图___________________;
④ [X(CN)5(NH3)]3-配离子中存在的化学键类型有_____________(填序号):
a、配位键 b、氢键 c、极性共价键 d、非极性共价键 e、离子键
参考答案:
【答案】 O 三角锥形 sp3 V sp2 极性 N H2O分子与乙醇分子间可形成氢键,而H2S不能 [Ar]3d6或1s22s22p63s23p63d6 【答题空10】14 mol ![]() ac
ac
【解析】本题主要考查分子结构。
元素X的4个未成对电子是3d电子,X是铁。Y原子最外层电子数是其内层电子总数的3倍,Y是氧。元素Z基态原子的3p轨道上有4个电子,Z是硫。W原子的2p轨道上有3个未成对电子,W是氮。
(1)①元素Y与Z中电负性较大的是O。
②离子ZY32-的中心原子S的价层电子对为4,其中有一孤电子对,其空间构型为三角锥形,杂化方式为sp3。
③ZY2的中心原子S的价层电子对为3,其中有一孤电子对,空间构型为V形,杂化方式sp2,分子中电荷发布不均匀,分子有极性。
④元素Y与W中N的2p电子处于半充满的较稳定状态,所以第一电离能较大的是N。
(2)Y的氢化物(H2Y)在乙醇中的溶解度大于H2Z,其原因是H2O分子与乙醇分子间可形成氢键,而H2S不能。
(3)①基态X2+的电子排布式是[Ar]3d6或1s22s22p63s23p63d6。
②1 mol配合物K3[X(CN)5(NH3)]中含σ键的数目为14mol。
③X原子的价电子排布图为![]() ;
;
④ [X(CN)5(NH3)]3-配离子中存在的化学键类型有ac。
-
科目: 来源: 题型:
查看答案和解析>>【题目】煤化工中常需研究不同温度下平衡常数、投料比及产率等问题。
已知CO(g)+H2O(g)
 H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表:
试回答下列问题:
(1)上述反应的正反应是________反应(填“放热”或“吸热”)。
(2)某温度下,上述反应达到平衡后,保持容器体积不变升高温度,逆反应速率________(填“增大”、“减小”或“不变”),容器内混合气体的压强________(填“增大”、“减小”或“不变”)。
(3)830℃时,在恒容反应器中发生上述反应,按下表中的物质的量投入反应混合物,其中向逆反应方向进行的有______(选填字母).

(4)在830℃时,在2 L的密闭容器中加入4 mol CO(g)和6 mol H2O(g)达到平衡时,H2(g)的体积分数是__________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】甲醇被称为2l世纪的新型燃料,工业上通过下列反应①和②,用CH4和H2O为原料来制备甲醇。
① CH4(g)+H2O(g)
 CO(g)+3H2(g) △H1
CO(g)+3H2(g) △H1② CO(g)+2H2(g)
 CH3OH(g) △H2
CH3OH(g) △H2将0.20mol CH4和0.30 mol H2O(g)通入容积为10L的密闭容器中,在一定条件下发生反应①,达到平衡时,CH4的转化率与温度、压强的关系如右图。

(1)已知在P1、100℃时达到平衡所需的时间为5min,则用CH4表示的平均反应速率为______。
(2)反应①的△H1____0,图中的P1______P2(填“<”、“=”或“>”)。
(3)在压强为0.1MPa条件下,将一定量CO与H2的混合气体在催化剂作用下能自发反应生成甲醇,则反应②的△H2____0,△S____0(填“<”、“=”或“>”)。
(4)根据题中给出的数据,计算反应①在100℃时的平衡常数值____________(写出计算过程及结果)
-
科目: 来源: 题型:
查看答案和解析>>【题目】化学与生活密切相关。下列说法错误的是
A. PM2.5是指粒径不大于2.5μm的可吸入悬浮颗粒物
B. 绿色化学要求从源头上消除或减少生产活动对环境的污染
C. 燃煤中加入CaO可以减少酸雨的形成及温室气体的排放
D. 天然气和液化石油气是我国目前推广使用的清洁燃料
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列说法正确的是
A.熵增大的反应一定是自发反应 B.焓增大的反应一定是自发反应
C.熵、焓都为正值的反应是自发反应 D.ΔHTΔS<0的反应一定是自发反应
-
科目: 来源: 题型:
查看答案和解析>>【题目】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
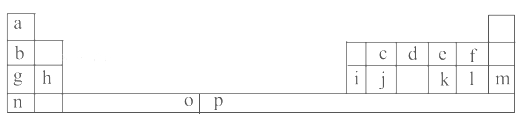
试回答下列问题:
(1)元素p为26号元素,请写出其原子的三价阳离子的电子排布式:______________。
(2)e与a反应的产物的分子中中心原子的杂化形式为__________,该分子是__________(填“极性”或“非极性”)分子。
(3)请写出f的氢化物在水中所存在氢键的表达式:(任写两种即可)_________________________。
(4)o、p两元素的部分电离能数据列于下表:
元素
o
p
电离能
/kJ·mol-1
I1
717
759
I2
1 509
1 561
I3
3 248
2 957
比较两元素的I2、I3可知,气态o2+再失去一个电子比气态p2+再失去一个电子难。对此,你的解释是___________________________________;
(5)i单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
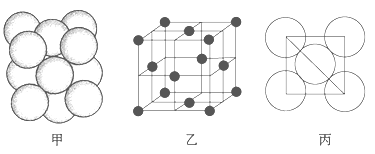
请问晶胞中i原子的配位数为________,一个晶胞中i原子的数目为________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列各组离子能够大量共存的是
A. Ag+、NH4+、CO32-、H+ B. Fe3+、H+、SCN-、NO3-
C. Na+、Fe2+、Cl-、NO3- D. H+、MnO4+、Cl-、NO3-
相关试题

