【题目】煤化工中常需研究不同温度下平衡常数、投料比及产率等问题。
已知CO(g)+H2O(g)![]() H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表:

试回答下列问题:
(1)上述反应的正反应是________反应(填“放热”或“吸热”)。
(2)某温度下,上述反应达到平衡后,保持容器体积不变升高温度,逆反应速率________(填“增大”、“减小”或“不变”),容器内混合气体的压强________(填“增大”、“减小”或“不变”)。
(3)830℃时,在恒容反应器中发生上述反应,按下表中的物质的量投入反应混合物,其中向逆反应方向进行的有______(选填字母).

(4)在830℃时,在2 L的密闭容器中加入4 mol CO(g)和6 mol H2O(g)达到平衡时,H2(g)的体积分数是__________。
参考答案:
【答案】 放热 增大 增大 AC 24%
【解析】(1)根据表中数据可知,温度升高平衡常数减小,说明平衡向逆反应方向移动,则正反应放热,故答案为:放热;
(2)温度升高,反应速率增大,平衡向逆反应方向移动,反应前后气体体积不变,等容容器中压强之比等于温度之比,所以压强增大,故答案为:增大;增大;
(3)根据830℃时,平衡常数k=1计算;
A、Q= (2×3)÷(5×1)=1.2>1,反应向逆反应方向移动,故A正确;
B、Q= (2.4×1.5)÷(2×2)=0.9<1,反应向正反应方向移动,故B错误;
C、Q= (3.2×2.5)÷(3.5×2)=1.14>1,反应向逆反应方向移动,故C正确;
D、Q= (0.5×2)÷(1×1)=1,达到平衡状态,平衡不移动,故D错误。
(4)830℃时,在2L的密闭容器中加入4molCO(g)和6molH2O(g)达到平衡时,设一氧化碳转化物质的量为x,依据平衡三段式列式得到
CO(g)+H2O(g)![]() H2(g)+CO2(g)
H2(g)+CO2(g)
起始量(mol): 4 6 0 0
变化量(mol): x x x x
平衡量(mol):4-x 6-x x x
平衡常数K= x2÷(4-x)×(6-x)=1 x=2.4mol
H2的体积分数= 2.4 ÷(1.6+3.6+2.4+2.4)×100%=24% 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下图表示实验室中常见的玻璃仪器,请回答下列有关问题。

(1)用仪器的字母填空:能用酒精灯直接加热的仪器是________,使用前要检查是否漏水的仪器有________,要分离汽油和水的混合物,应选择的仪器是________。
(2)b的名称是________。
(3)c常用于盛放固体试剂,实验室中下列试剂不能盛放其中的是________。
A.烧碱 B.锌粒 C.活性炭 D.石灰石
(4)下图是为完成相应实验的装置图,请分析指出其中一处错误。

A______________, B______________, C______________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】
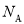 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是A. 0.1 mol 的
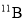 中,含有
中,含有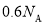 个中子
个中子B. pH=1的H3PO4溶液中,含有
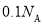 个
个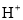
C. 2.24L(标准状况)苯在O2中完全燃烧,得到
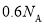 个CO2分子
个CO2分子D. 密闭容器中1 mol PCl3与1 mol Cl2反应制备 PCl5(g),增加
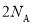 个P-Cl键
个P-Cl键 -
科目: 来源: 题型:
查看答案和解析>>【题目】下列说法正确的是
A. 0.1 molL-1的NaCl溶液是指此溶液中含有0.1 mol NaCl
B. 1 molL-1的BaCl2溶液中,Cl-的物质的量浓度为2 molL-1
C. 从1 L 0.5 molL-1的NaCl溶液中取出100 mL溶液,其物质的量浓度变为0.05 molL-1
D. 在
 和
和 的混合水溶液中,如果
的混合水溶液中,如果 和
和 的物质的量浓度相等,则
的物质的量浓度相等,则 和
和 的物质的量浓度相同
的物质的量浓度相同 -
科目: 来源: 题型:
查看答案和解析>>【题目】甲醇被称为2l世纪的新型燃料,工业上通过下列反应①和②,用CH4和H2O为原料来制备甲醇。
① CH4(g)+H2O(g)
 CO(g)+3H2(g) △H1
CO(g)+3H2(g) △H1② CO(g)+2H2(g)
 CH3OH(g) △H2
CH3OH(g) △H2将0.20mol CH4和0.30 mol H2O(g)通入容积为10L的密闭容器中,在一定条件下发生反应①,达到平衡时,CH4的转化率与温度、压强的关系如右图。

(1)已知在P1、100℃时达到平衡所需的时间为5min,则用CH4表示的平均反应速率为______。
(2)反应①的△H1____0,图中的P1______P2(填“<”、“=”或“>”)。
(3)在压强为0.1MPa条件下,将一定量CO与H2的混合气体在催化剂作用下能自发反应生成甲醇,则反应②的△H2____0,△S____0(填“<”、“=”或“>”)。
(4)根据题中给出的数据,计算反应①在100℃时的平衡常数值____________(写出计算过程及结果)
-
科目: 来源: 题型:
查看答案和解析>>【题目】化学与生活密切相关。下列说法错误的是
A. PM2.5是指粒径不大于2.5μm的可吸入悬浮颗粒物
B. 绿色化学要求从源头上消除或减少生产活动对环境的污染
C. 燃煤中加入CaO可以减少酸雨的形成及温室气体的排放
D. 天然气和液化石油气是我国目前推广使用的清洁燃料
-
科目: 来源: 题型:
查看答案和解析>>【题目】元素X位于第四周期,其基态原子有4个未成对电子。Y原子最外层电子数是其内层电子总数的3倍,元素Z基态原子的3p轨道上有4个电子,W原子的2p轨道上有3个未成对电子。
(1)Y与W、Z可形成多种化合物。
①元素Y与Z中电负性较大的是_________________(用元素符号描述)。
②离子ZY32-的空间构型为_______________ (用文字描述),杂化方式______________。
③ZY2空间构型_________,杂化方式________,分子的极性________(填“极性”或“非极性”)。
④元素Y与W中第一电离能较大的是___________________(用元素符号描述)。
(2)Y的氢化物(H2Y)在乙醇中的溶解度大于H2Z,其原因是_____________。
(3)含X2+的溶液与KCN、氨水反应可得到化合物K3[X(CN)5(NH3)]。
①基态X2+的电子排布式是________________。
②1 mol配合物K3[X(CN)5(NH3)]中含σ键的数目为___________。
③画出X原子的价电子排布图___________________;
④ [X(CN)5(NH3)]3-配离子中存在的化学键类型有_____________(填序号):
a、配位键 b、氢键 c、极性共价键 d、非极性共价键 e、离子键
相关试题

