【题目】为了测定铁铜合金的组成,将7.6g铁、铜合金加入100mL某浓度的稀硝酸中,将合金完全溶解后,共收集到NO气体2.24L(标准状况下),并测得溶液中H+的浓度为0.5molL﹣1 , 若反应前后溶液的体积变化忽略不计,则下列判断正确的是( )
A.上述反应中金属共失去电子0.1mol
B.合金中,铜的质量为2.8g
C.原硝酸的浓度:c(HNO3)=4.5molL﹣1
D.要使溶液中的金属离子完全沉淀,需加5molL﹣1的NaOH溶液60mL
参考答案:
【答案】C
【解析】解:n(NO)= ![]() =0.1mol,则转移电子为0.1mol×(5﹣2)=0.3mol,反应后溶液中的c(H+)=0.5mol/L,则反应后剩余n(HNO3)=0.5mol/L×0.1L=0.05mol,设合金中Cu为xmol,Fe为ymol,由电子守恒可知:2x+3y=0.3mol,由合金的质量可知:64x+56y=7.6,解得x=0.075mol,y=0.05mol,
=0.1mol,则转移电子为0.1mol×(5﹣2)=0.3mol,反应后溶液中的c(H+)=0.5mol/L,则反应后剩余n(HNO3)=0.5mol/L×0.1L=0.05mol,设合金中Cu为xmol,Fe为ymol,由电子守恒可知:2x+3y=0.3mol,由合金的质量可知:64x+56y=7.6,解得x=0.075mol,y=0.05mol,
A.由分析可知,金属共失去电子0.3 mol,故A错误;
B.合金中,铜的质量为0.075mol×64=4.8 g,故B错误;
C.反应生成Cu(NO3)2、Fe(NO3)3和NO,以及剩余的硝酸,根据氮原子守恒可知,n(HNO3)=0.075×2+0.05×3+0.1+0.05=0.45mol,则c(HNO3)= ![]() =
= ![]() =4.5mol/L,故C正确;
=4.5mol/L,故C正确;
D.要使溶液中的金属离子完全沉淀,溶液中的溶质为NaNO3 , n(NaNO3)=n(NaOH)=0.075×2+0.05×3+0.05=0.35mol,V= ![]() =
= ![]() =0.07L=70mL,故D错误.
=0.07L=70mL,故D错误.
故选C.
-
科目: 来源: 题型:
查看答案和解析>>【题目】已知酸H2B在水溶液中存在下列关系:①H2B=H++HB-,②HB-
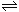 H++B2-,则下列说法中一定正确的是
H++B2-,则下列说法中一定正确的是A. 在Na2B溶液中一定有:c(OH
 )=c(H
)=c(H )+c(HB
)+c(HB )+2c(H2B)
)+2c(H2B)B. NaHB溶液可能存在以下关系:c(Na
 )>c(HB
)>c(HB )>c(OH
)>c(OH )>c(H
)>c(H )
)C. NaHB水溶液中一定有:c(Na
 )+c(H
)+c(H )=c(HB
)=c(HB )+c(OH
)+c(OH )+c(B
)+c(B )
)D. NaHB溶液一定呈酸性,Na2B溶液一定呈碱性
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列关于Na2CO3和NaHCO3的叙述正确的是
A. Na2CO3俗名苏打,NaHCO3俗名纯碱
B. 受热时,NaHCO3比Na2CO3容易分解
C. Na2CO3溶液显碱性,NaHCO3溶液显酸性
D. Na2CO3和NaHCO3各lmol分别与足量的盐酸充分反应,产生CO2质量不相等
-
科目: 来源: 题型:
查看答案和解析>>【题目】设NA表示阿伏加德罗常数的值,下列说法中正确的是
A. 16g CH4含有的原子数为NA
B. 17 g OH- 含有的质子数为9NA
C. 2g D2气体中含有的中子数为0.5 NA
D. 标准状况下22.4 L NH3含有的电子数为NA
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列反应中,属于取代反应的是
A. 乙烯与溴的四氯化碳溶液反应 B. 苯在一定条件下与氢气反应
C. 甲烷与氯气在光照条件下反应 D. 乙醇在一定条件下生成乙醛
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图是一些重要工业生产的转化关系(反应条件略去):请完成下列问题:
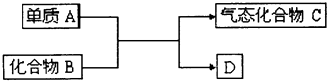
(1)若D是单质,且与A属于同一主族,反应在高温下进行,则:
①此反应的化学方程式是 .
②D单质的一种重要用途是 .
(2)若B为黄色固体,D为固体化合物,则该反应为4FeS2+11O2 2Fe2O3+8SO2
2Fe2O3+8SO2
①当有1molC生成时,该反应转移电子的总数是 .
②将C通入足量的酸性KMnO4 溶液中,发生反应的离子方程式为 .
(3)若B是一种碱性气体,D为化合物,则:
①该反应的化学方程式是 .
②B在加热条件下与CuO反应有Cu生成,该反应的化学方程式为;有人提出产物Cu中可能还含有Cu2O.已知Cu+在酸性溶液中不能稳定存在,为验证Cu2O是否存在,可取少量反应产物,滴加足量稀硫酸,若溶液由无色变为蓝色,则证明含有Cu2O.请写出发生反应的化学方程式: . -
科目: 来源: 题型:
查看答案和解析>>【题目】根据问题填空:
(1)工业上利用CO2与NH3混合,在一定条件下反应合成尿素: 2NH3(g)+CO2(g)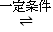 CO(NH2)2(S)+H2O(g)△H
CO(NH2)2(S)+H2O(g)△H
若该反应在一恒温、恒容密闭容器内进行,判断反应达到平衡状态的标志是 .
a.CO2与H2O(g)浓度相等 b.容器中气体的压强不再改变
c.2v(NH3)正=v(H2O)正 d.容器中氨气的浓度不再改变
(2)硫酸锌可广泛用作印染媒染剂和木材防腐剂. ZnSO4受热分解过程中各物质物质的量随温度变化关系如图1所示.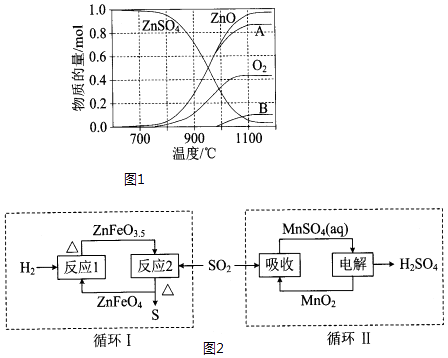
①写出700℃~980℃时发生反应的化学方程式: , 物质B的化学式是 . (A、B均为硫的氧化物)
②硫酸锌分解生成的SO2经图2中的两个循环可分别得到S和H2SO4 . 写出循环I中反应2的化学方程式:;循环II中用惰性电极电解,阳极反应式是 .
相关试题

