【题目】已知酸H2B在水溶液中存在下列关系:①H2B=H++HB-,②HB-![]() H++B2-,则下列说法中一定正确的是
H++B2-,则下列说法中一定正确的是
A. 在Na2B溶液中一定有:c(OH![]() )=c(H
)=c(H![]() )+c(HB
)+c(HB![]() )+2c(H2B)
)+2c(H2B)
B. NaHB溶液可能存在以下关系:c(Na![]() )>c(HB
)>c(HB![]() )>c(OH
)>c(OH![]() )>c(H
)>c(H![]() )
)
C. NaHB水溶液中一定有:c(Na![]() )+c(H
)+c(H![]() )=c(HB
)=c(HB![]() )+c(OH
)+c(OH![]() )+c(B
)+c(B![]() )
)
D. NaHB溶液一定呈酸性,Na2B溶液一定呈碱性
参考答案:
【答案】D
【解析】试题分析:酸H2B在水溶液中第一步完全电离,第二步部分电离,所以B2-只能发生一步水解,则A、B2-只能发生一步水解,所以溶液中不存在H2B,溶液中存在质子守恒为c(OH-) = c(H+) + c(HB-),A错误;B、HB-在水溶液里只能电离不能水解,导致溶液呈酸性,所以c(OH-)<c(H+),B错误;C、任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(Na+)+ c(H+) = c(HB-) + c(OH-) + 2c(B2-),C错误;D、HB-在水溶液里只能电离不能水解,B2-只能发生一步水解,所以NaHB溶液一定呈酸性,Na2B溶液一定呈碱性,D正确,答案选D。
-
科目: 来源: 题型:
查看答案和解析>>【题目】298 K时,在2 L固定体积的密闭容器中,发生可逆反应:2NO2(g)
 N2O4(g) ΔH=-a kJ/mol(a>0)。N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,若反应在398 K进行,某时刻测得n(NO2)=0.6 mol,n(N2O4)=1.2 mol,则此时,下列大小关系正确的是( )
N2O4(g) ΔH=-a kJ/mol(a>0)。N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,若反应在398 K进行,某时刻测得n(NO2)=0.6 mol,n(N2O4)=1.2 mol,则此时,下列大小关系正确的是( )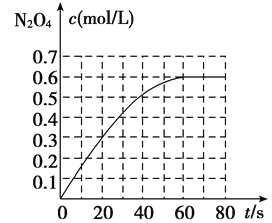
A. v(正)>v(逆)
B. v(正)<v(逆)
C. v(正)=v(逆)
D. v(正)、v(逆)大小关系不确定
-
科目: 来源: 题型:
查看答案和解析>>【题目】把7.2g铁粉投入40ml某HNO3溶液中,充分反应后剩余固体1.6g,产生NO2和NO的混合气体0.08mol,若不考虑N2O4的存在,则原HNO3溶液的物质的量浓度( )
A.3.5 mol/L
B.4.5 mol/L
C.7.0 mol/L
D.9.0 mol/L -
科目: 来源: 题型:
查看答案和解析>>【题目】下列物质中,含有离子键的是( )
A.HClB.H2O2C.K2OD.H2SO4
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列关于Na2CO3和NaHCO3的叙述正确的是
A. Na2CO3俗名苏打,NaHCO3俗名纯碱
B. 受热时,NaHCO3比Na2CO3容易分解
C. Na2CO3溶液显碱性,NaHCO3溶液显酸性
D. Na2CO3和NaHCO3各lmol分别与足量的盐酸充分反应,产生CO2质量不相等
-
科目: 来源: 题型:
查看答案和解析>>【题目】设NA表示阿伏加德罗常数的值,下列说法中正确的是
A. 16g CH4含有的原子数为NA
B. 17 g OH- 含有的质子数为9NA
C. 2g D2气体中含有的中子数为0.5 NA
D. 标准状况下22.4 L NH3含有的电子数为NA
-
科目: 来源: 题型:
查看答案和解析>>【题目】为了测定铁铜合金的组成,将7.6g铁、铜合金加入100mL某浓度的稀硝酸中,将合金完全溶解后,共收集到NO气体2.24L(标准状况下),并测得溶液中H+的浓度为0.5molL﹣1 , 若反应前后溶液的体积变化忽略不计,则下列判断正确的是( )
A.上述反应中金属共失去电子0.1mol
B.合金中,铜的质量为2.8g
C.原硝酸的浓度:c(HNO3)=4.5molL﹣1
D.要使溶液中的金属离子完全沉淀,需加5molL﹣1的NaOH溶液60mL
相关试题

