【题目】H2O2分解速率受多种因素影响。实验测得70℃时不同条件下H2O2浓度随时间的变化如图所示。下列说法正确的是( )
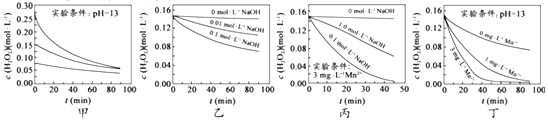
A. 图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快
B. 图乙表明,其他条件相同时,溶液PH 越小,H2O2分解速率越快
C. 图丙表明,少量Mn2+存在时,溶液碱性越强,H2O2分解速率越快
D. 图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
参考答案:
【答案】D
【解析】A、由甲图可知,双氧水浓度越大,分解越快,选项A错误;B、由图乙可知,溶液的碱性越强即pH越大,双氧水分解越快,选项B错误;C、根据变量控制法,3个实验必须加入等量的Mn2+才能比较溶液的碱性对双氧水分解的影响。由图丙可知,3个实验中由于仅在其中一个加了Mn2+,选项C错误;D、由图丙和图丁可知,溶液的碱性越强、Mn2+浓度越大,双氧水分解越快,选项D正确。答案选D。
-
科目: 来源: 题型:
查看答案和解析>>【题目】
A. C、O、Ca、K B. O、C、H、N
C. O、C、N、P D. C、H、O、P
-
科目: 来源: 题型:
查看答案和解析>>【题目】下图是金属镁和卤素单质(X2)反应的能量变化示意图。下列叙述中,正确的说法有几项 ( )

①Mg(s)所具有的能量高于MgX2(s)所具有的能量
②MgCl2电解制Mg(s)和Cl2(g)是吸热过程
③热稳定性:MgI2>MgBr2>MgCl2>MgF2
④常温下氧化性:F2<Cl2<Br2<I2
A. 1项 B. 2项
C. 3项 D. 4项
-
科目: 来源: 题型:
查看答案和解析>>【题目】某小组同学设想用如图装置电解硫酸钾溶液来制取氧气、氢气、硫酸和氢氧化钾.
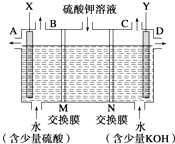
(1)X极与电源的(填“正”或“负”)极相连,氢气从(填“A”、“B”、“C”或“D”)口导出.
(2)离子交换膜只允许一类离子通过,则M为(填“阴离子”或“阳离子”)
(3)若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池(石墨为电极),则电池负极的反应式为 .
(4)若在标准状况下制得11.2L氢气,则生成硫酸的质量是 , 转移的电子数为 . -
科目: 来源: 题型:
查看答案和解析>>【题目】如图是利用废铜屑(含杂质)制备胆矾(硫酸铜晶体)的过程
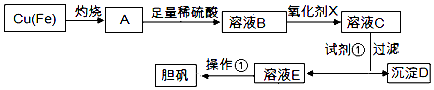
已知:溶液中被沉淀的离子
Fe3+
Fe2+
Cu2+
完全生成氢氧化物的沉淀时,溶液的pH
≥3.7
≥6.4
≥4.4
请回答:
(1)下列物质中最适宜做氧化剂X的是(填字母).
A.NaClO
B.H2O2
C.KMnO4
D.FeCl3
(2)加入试剂①是为了调节pH,试剂①可以选择(填化学式).
(3)操作①的名称是 .
(4)沉淀D加入盐酸可以得到FeCl3溶液,关于FeCl3溶液的性质中说法不正确的是 .
A.将FeCl3饱和溶液逐滴加入沸水中,并继续加热得到红褐色液体,该液体能产生丁达尔效应
B.向FeCl3溶液滴加NaOH溶液,出现红褐色沉淀
C.将FeCl3溶液滴加NaOH溶液,将沉淀干燥灼烧,得到Fe(OH)3固体
D.向FeCl3溶液中滴加KSCN溶液,溶液变为红色
(5)沉淀D加入盐酸和铁粉,可以制得FeCl2溶液,实验室保存FeCl2溶液,需加入过量的铁粉防止FeCl2溶液变质,其原因是(用离子方程式表示).
(6)若用碳电极电解硫酸铜溶液200mL.通电5min后,阴极增重0.64g,则电解后溶液的pH=(溶液体积变化忽略不计). -
科目: 来源: 题型:
查看答案和解析>>【题目】下列说法中不正确的是( )
A. H与O可形成既含极性共价键又含非极性共价键的化合物
B. 28g由 C2H4和 C3H6组成的混合物中,H原子的数目为4NA
C. 在D218O中,质量数之和是质子数之和的两倍
D. 1mol —CH3中含有的电子数为9NA
-
科目: 来源: 题型:
查看答案和解析>>【题目】一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示,下列描述正确的是( )
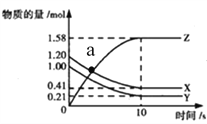
A. 反应的化学方程式为X(g)+Y(g)===Z(g)
B. a点正、逆反应速率相等
C. 反应开始到10s,用Z表示的反应速率为0.158mol/(L·s)
D. 反应开始到10s,Y转化率为79%
相关试题

