【题目】
A. C、O、Ca、K B. O、C、H、N
C. O、C、N、P D. C、H、O、P
参考答案:
【答案】B
【解析】试题分析:1、C、H、O、N、P、S这六种元素的含量占到了细胞总量的97%,称为主要元素.
2、C、H、O、N基本元素占鲜重的比例从大到小的顺序是:O>C>H>N;
3、C、H、O、N基本元素占干重的比例从大到小的顺序是:C>O>N>H.
解:C、H、O、N、P、S这六种元素的含量占到了细胞总量的97%,称为主要元素.占细胞鲜重比例最大的元素是氧.C、H、O、N、P、S,占鲜重的比例从大到小的顺序是:O>C>H>N>P>S.
故选:B.
-
科目: 来源: 题型:
查看答案和解析>>【题目】NOx在阳光的作用下会引起光化学烟雾,从而造成严重的大气污染。火力发电厂烟气中含有大量氮氧化物,必须对燃烧后的烟气进行处理,其原理如下(已知:燃烧系统排放烟气中的NOx,90%以上是NO):

请回答:
(1)NO2气体的颜色为______。
(2)下列物质可作试剂A的是______(填字母)。
a.O3 b.CO c.NH3 d.ClO2
(3)试剂B可使用Na2SO3溶液,该反应的化学方程式为______。
(4)NO2还可以用NaOH溶液吸收(原理:2NO2+2NaOH===NaNO2+NaNO3+H2O)。取一定量 NO2用过量的V1 mL c1 mol·L1NaOH溶液吸收完全,剩余NaOH用V2 mL c2 mol·L1 H2SO4溶液恰好中和,则被吸收的NO2物质的量是______。
-
科目: 来源: 题型:
查看答案和解析>>【题目】结合所学内容回答下列问题:
Ⅰ.某实验小组以H2O2的分解为例,研究浓度、催化剂、温度对化学反应速率的影响,按照如下方案设计实验。
实验编号
反应物
催化剂
温度
①
10 mL 2% H2O2溶液
无
20℃
②
10 mL 5% H2O2溶液
无
20℃
③
10 mL 5% H2O2溶液
1-2滴1 mol/LFeCl3溶液
20℃
④
10 mL 5% H2O2溶液
无
20℃
⑤
10 mL 5% H2O2溶液
⑥
无
20℃
(1)实验①和②的目的是研究_______________对反应速率的影响。
(2)实验③和④测得生成氧气的体积随时间变化的关系如下图所示。
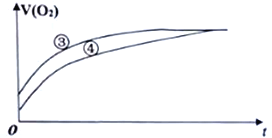
分析上图能够得出的实验结论是________________________________________________。
(3)实验⑤和⑥是研究温度相差10℃对反应速率的影响,请在上面表格空白处补齐对应的内容_________。
Ⅱ.某温度时,在2L的容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。请通过计算回答下列问题:
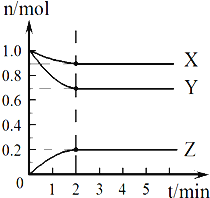
(4)反应开始至2 min,Z的平均反应速率____________。
(5)保持容器容积不变,在第2min时改变下列条件时,化学反应速率的变化是:
①向其中充入1 molX气体,化学反应速率_______(填 “加快”“减慢”或“不变”,下同);
②向其中充入1 mol N2(g) (N2不参加反应),化学反应速率_______________;
③同时加入0.9molX、0.7molY 和0.2molZ,化学反应速率________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】【化学选修3:物质结构与性质】铝、铁在生活、生产中有着广泛的用途,请回答下列问题。
(1)Fe2+的最外层电子排布式____________。元素Fe与Mn的第三电离能分别为I3(Fe)、I3(Mn),则I3(Fe)______I3(Mn)(填“>”、“<")。
(2)第四周期中,与Al原子未成对电子数相同的金属元素有____种。气态氯化铝的分子组成为(AlCl3)2,其中Al、Cl均达8e-稳定结构,Al原子的杂化方式为__________。根据等电子原理,AlO2-的空间构型为_____。
(3)Fe(CO)5的熔点为-20℃,沸点为103℃,易溶于乙醚,其晶体类型为______,晶体中σ键和π键的数目之比为______。
(4)科学家们发现某些含铁的物质可催化尿素合成肼(N2H4),沸点:N2H4>C2H6的主要原因为____________。
(5)FeO晶体的晶胞如图所示,己知:FeO晶体的密度为ρg/cm3,NA代表阿伏加德罗常数的值。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为_____;Fe2+与O2-最短核间距为______pm(用ρ和NA表示)。
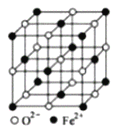
-
科目: 来源: 题型:
查看答案和解析>>【题目】下图是金属镁和卤素单质(X2)反应的能量变化示意图。下列叙述中,正确的说法有几项 ( )

①Mg(s)所具有的能量高于MgX2(s)所具有的能量
②MgCl2电解制Mg(s)和Cl2(g)是吸热过程
③热稳定性:MgI2>MgBr2>MgCl2>MgF2
④常温下氧化性:F2<Cl2<Br2<I2
A. 1项 B. 2项
C. 3项 D. 4项
-
科目: 来源: 题型:
查看答案和解析>>【题目】某小组同学设想用如图装置电解硫酸钾溶液来制取氧气、氢气、硫酸和氢氧化钾.
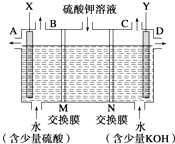
(1)X极与电源的(填“正”或“负”)极相连,氢气从(填“A”、“B”、“C”或“D”)口导出.
(2)离子交换膜只允许一类离子通过,则M为(填“阴离子”或“阳离子”)
(3)若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池(石墨为电极),则电池负极的反应式为 .
(4)若在标准状况下制得11.2L氢气,则生成硫酸的质量是 , 转移的电子数为 . -
科目: 来源: 题型:
查看答案和解析>>【题目】H2O2分解速率受多种因素影响。实验测得70℃时不同条件下H2O2浓度随时间的变化如图所示。下列说法正确的是( )
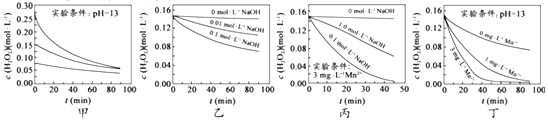
A. 图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快
B. 图乙表明,其他条件相同时,溶液PH 越小,H2O2分解速率越快
C. 图丙表明,少量Mn2+存在时,溶液碱性越强,H2O2分解速率越快
D. 图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
相关试题

