【题目】100℃时,在1 L恒温恒容的密闭容器中,通入0.1molN2O4,发生反应:N2O4(g)![]() 2NO2(g)ΔH=+57.0kJ·mol-1,NO2和N2O4的浓度随时间变化情况如图所示。
2NO2(g)ΔH=+57.0kJ·mol-1,NO2和N2O4的浓度随时间变化情况如图所示。

Ⅰ.(1)在0~60 s内,以N2O4表示的平均反应速率为____mol·L-1·s-1。
(2)反应进行到100s时,若只有一项条件发生变化,则变化的条件可能是____。
A.降低温度 B.通入氦气
C.又往容器中充入N2O4 D.增大容器容积
(3)已知: N2(g)+2O2(g)=2NO2(g) ΔH=+67.2kJ·mol-1,N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-534.7kJ·mol-1,N2O4(g)=2NO2(g) ΔH=+57.0kJ·mol-1,则2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ΔH=____kJ·mol-1。
Ⅱ.向容积为2 L的密闭容器中通入一定量的CO和H2O,发生反应:CO(g)+H2O(g)![]() H2(g)+CO2(g)。
H2(g)+CO2(g)。
(4)保持其他条件不变:
①若向平衡体系中再通入0.20molH2O(g),平衡将___(填“向右”、“向左”或“不”)移动,达到新的平衡状态后,H2O(g)的体积分数将____(“变大”、“变小”或“不变”);
②在VL密闭容器中通入10molCO和10molH2O(g)发生上述反应,在T℃达到平衡,然后急速除去水蒸气(除水蒸气时其他各成分的物质的量不变),将混合气体燃烧,测得放出的热量为2842kJ(已知CO的燃烧热为283kJ·mol-1,H2的燃烧热为286kJ·mol-1),则T℃平衡常数K=____。(精确到小数点后两位)
参考答案:
【答案】1×10-3 A -1079.6 向右 变大 0.44
【解析】
由图甲可知,起始时c(N2O4)=0.1mol/L,60秒时反应处于平衡状态时c(N2O4)=0.04mol/L,c(NO2)=0.12mol/L,
(1)根据v=△c/△t计算反应速率;
(2).根据平衡移动及各量的变化情况进行判断;
(3)根据盖斯定律计算出反应热,写出热化学方程式
(4)CO、H2的物质的量各为10mol,根据燃烧放出的热量求出CO、H2各自的物质的量,利用三段式法求出平衡时各组分的物质的量,代入平衡常数计算.
Ⅰ由图甲可知,起始时c(N2O4)=0.1mol/L,60秒时反应处于平衡状态时c(N2O4)=0.04mol/L,c(NO2)=0.12mol/L,(1)根据v=△c/△t,以N2O4表示的平均反应速率为(0.1mol/L0.04mol/L)![]() 60s=1×10-3mol/(Ls),
60s=1×10-3mol/(Ls),
故答案为为:1×103;
(2)A. 该反应是吸热反应,降低温度,平衡左移,c(NO2)减小,c(N2O4)增大,与图像相符,故A选;
B. 恒温恒容通入氦气,平衡不移动,各组分浓度不变,与图像不符,故B不选;
C.又往容器中充入N2O4,100s时N2O4浓度增大,c(NO2)也增大,N2O4浓度曲线应断开,和图像不符,故C不选;
D. 增大容器体积,各组分的浓度都减小,和图像不符,故D不选;
故选A。
(3)①N2(g)+2O2(g)=2NO2(g) ΔH=+67.2kJ·mol-1.
②N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-534.7kJ·mol-1,
③N2O4(g)=2NO2(g) ΔH=+57.0kJ·mol-1
根据盖斯定律,②×2①+③可写出热化学方程式2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) △H=534.7kJmol1×267.2kJmol1+57.0kJmol1=1079.6kJmol1,
故答案为:1079.6.
Ⅱ①保持其他条件不变,向平衡体系中再通入0.20 mol H![]() O(g),与原平衡相比平衡向右移动,但由于通入了H
O(g),与原平衡相比平衡向右移动,但由于通入了H![]() O(g),故达到新的平衡状态后,H
O(g),故达到新的平衡状态后,H![]() O(g)的体积分数变大;
O(g)的体积分数变大;
②由方程式CO(g)+H2O(g)H2(g)+CO2(g)可知,1molCO反应生成1molH2,开始通入10molCO,平衡时CO、H2的物质的量之和为10mol
设CO、H2物质的量为x、y,则:![]() ,
,
解得:![]() ,
,
利用三段式法求出平衡时各组分的物质的量,
CO(g)+H2O(g)H2(g)+CO2(g),
起始:10mol10mol00
转化:4mol4mol4mol4mol
平衡:6mol6mol4mol4mol所以T℃时反应的平衡常数为:K=![]() =
=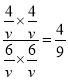 =0.44
=0.44
故答案为:0.44
-
科目: 来源: 题型:
查看答案和解析>>【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是

A. 通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C. 负极反应为2H2O–4e–=O2+4H+,负极区溶液pH降低
D. 当电路中通过1mol电子的电量时,会有0.5mol的O2生成
-
科目: 来源: 题型:
查看答案和解析>>【题目】某温度下,三个容积均为2.0 L恒容密闭容器中发生反应2NO(g)+2CO(g)
 N2(g)+2CO2(g),各容器中起始物质的量浓度与反应温度如下表所示:
N2(g)+2CO2(g),各容器中起始物质的量浓度与反应温度如下表所示:容器
温度/℃
起始物质的量浓度/(mol·L-1)
NO(g)
CO(g)
N2
CO2
甲
T1
0.10
0.10
0
0
乙
T2
0
0
0.10
0.20
丙
T2
0.10
0.10
0
0

反应过程中甲、丙容器中CO2的物质的量随间变化关系如图所示。下列说法正确的是
A.该反应的正反应为放热反应,平衡常数K(T1)<K(T2)
B.达到平衡时,乙容器中的压强一定大于甲容器的2倍
C.乙容器中反应达到平衡时,N2的转化率大于40%
D.丙容器中反应达到平衡后,再充入0.10 mol NO和0.10 mol CO2,此时v(正)>v(逆)
-
科目: 来源: 题型:
查看答案和解析>>【题目】按要求填空:
(1)在室温下,等体积、等浓度的氢氧化钠与醋酸混合后溶液呈__性,溶液中c(Na+)__c(CH3COO-)(填“>”“=”或“<”);pH=13的氢氧化钠与pH=1的醋酸等体积混合后溶液呈__性,溶液中c(Na+)___c(CH3COO-)(填“>”“=”或“<”);
(2)下列溶液,①0.1mol/L HCl溶液②0.1mol/L H2SO4溶液③0.1mol/L NaOH溶液④0.1mol/L CH3COOH溶液,按pH由小到大顺序为______________。
(3)CuSO4的水溶液呈酸性的原因是(用离子方程式表示):____;实验室在配制CuSO4的溶液时,常将CuSO4固体先溶于较浓的硫酸中,然后再用蒸馏水稀释到所需的浓度,以___(填“促进”、“抑制”)其水解。
(4)已知:难溶电解质Cu(OH)2在常温下的KSP=2×10-20,则常温下:某CuSO4溶液中c(Cu2+)=0.02molL-1,如要生成Cu(OH)2沉淀,应调整溶液的pH最小为____。
-
科目: 来源: 题型:
查看答案和解析>>【题目】H2C2O4水溶液中部分微粒的分布分数δ与pH关系如图所示,下列说法正确的是

A.向H2C2O4溶液中滴加NaOH溶液至pH=2.5:c(H2C2O4)+c(C2O42-)>c(HC2O4-)
B.由图可知:H2C2O4的Ka2=10-4.2
C.向H2C2O4溶液中滴加NaOH溶液至pH=7,则溶液中:2c(C2O42-)>c(Na+)
D.将0.01 mol·L-1的H2C2O4溶液与0.02 mol·L-1 NaOH溶液等体积混合后的溶液中:c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4)
-
科目: 来源: 题型:
查看答案和解析>>【题目】亚氯酸钠(NaClO2)是一种高效的漂白剂和氧化剂,可用于各种纤维和某些食品的漂白。马蒂逊(Mathieson)法制备亚氯酸钠的流程如下:

下列说法错误的是( )
A.反应①阶段,参加反应的NaClO3和SO2的物质的量之比为2:1
B.若反应①通过原电池来实现,则ClO2是正极产物
C.反应②中的H2O2可用NaClO4代替
D.反应②条件下,ClO2的氧化性大于H2O2
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图所示,常温下通电5
 后,发现铜电极的质量增加,试回答:
后,发现铜电极的质量增加,试回答:
(1)电源电极
 的名称为________(填“正极”或“负极”)。
的名称为________(填“正极”或“负极”)。(2)电解池
 中阳极的电极反应式是____________。
中阳极的电极反应式是____________。(3)若
 溶液的体积是200
溶液的体积是200  ,则当铜电极的质量增加2. 16
,则当铜电极的质量增加2. 16  时
时 中溶液的
中溶液的 ____________ (忽略电解前后溶液体积的变化),若要使电解后的溶液恢复到与电解前完全相同的状态,则应加入____________(填物质的种类及数量)。
____________ (忽略电解前后溶液体积的变化),若要使电解后的溶液恢复到与电解前完全相同的状态,则应加入____________(填物质的种类及数量)。(4)已知电解前,电解池B中铜银两电极的质量相等,通电一段时间后,当铜银两电极的质量差为2.16
 时,电解池A中生成的气体最多为________
时,电解池A中生成的气体最多为________ 。
。
相关试题

