【题目】A、B、C、D、E、F属于短周期主族元素.A的原子半径是短周期中最大,B元素的原子最外层电子数为m、次外层电子数为n,C元素的原子L层电子数为m+n,M层电子数为m﹣n,D元素与C元素同主族,E元素原子与B元素原子的核外电子数之比为2:1,F的一种原子中,质量数与质子数之差为零.
(1)B2﹣的离子结构示意图 , DE2的电子式 .
(2)A、B形成的简单离子的半径由大到小的顺序为(用具体符号表示).
(3)A、E形成的是(填共价或离子)化合物
(4)C在周期表中的位置是
(5)由元素C形成的单质Y与由A,B,F三种元素形成的化合物X的水溶液反应的离子方程式为 .
参考答案:
【答案】
(1) ;
;![]()
(2)Na+<O2﹣
(3)离子
(4)第三周期第ⅣA
(5)Si+H2O+2OH﹣═SiO32﹣+2H2↑
【解析】解:由分析可知:A为Na元素;B为O元素;C为Si元素;D为C元素;E为S元素;F为H元素;
(1.)O2﹣的离子结构示意图  ,CS2的电子式类似于CO2 , 电子式为
,CS2的电子式类似于CO2 , 电子式为 ![]() ,所以答案是:
,所以答案是:  ;
; ![]() ;
;
(2.)电子层结构相同,核电荷数越多半径越小,所以Na+的半径小于O2﹣的半径,所以答案是:Na+<O2﹣;
(3.)Na、S形成的硫化钠是离子化合物,所以答案是:离子化合物;
(4.)14号元素Si,三个电子层,最外层4个电子,所以在周期表中的位置是第三周期,第ⅣA,所以答案是:第三周期第ⅣA;
(5.)元素Si形成的单质Si与由Na、O、H三种元素形成的化合物氢氧化钠的水溶液反应的离子方程式为:Si+H2O+2OH﹣═SiO32﹣+2H2↑,所以答案是:Si+H2O+2OH﹣═SiO32﹣+2H2↑.
-
科目: 来源: 题型:
查看答案和解析>>【题目】ClO2与Cl2的氧化性相近,在自来水消毒和果蔬保鲜等方面应用广泛.某兴趣小组通过图1装置(夹持装置略)对其制备、吸收、释放和应用进行了研究.
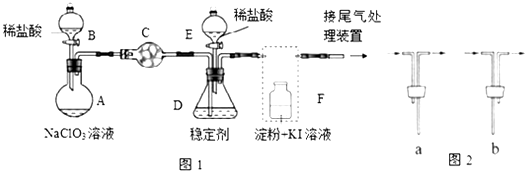
(1)仪器D的名称是 , 仪器E的名称是 . 安装F中导管时,应选用图2中的 .
(2)打开B的活塞,A中发生反应:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O,这个反应中氧化剂和还原剂的物质的量之比为 , 为使ClO2在D中被稳定剂充分吸收,滴加稀盐酸的速度宜(填“快”或“慢”).
(3)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2 , 此时F中溶液的颜色不变,则装置C的作用是 .
(4)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2 , 该反应的离子方程式为 , 在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是 .
(5)已吸收ClO2气体的稳定剂Ⅰ和稳定剂Ⅱ,加酸后释放ClO2的浓度随时间的变化如图3所示.若将其用于水果保鲜,你认为效果较好的稳定剂是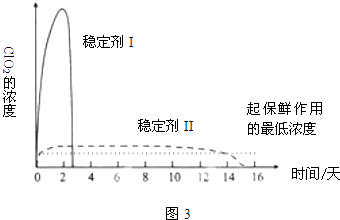
-
科目: 来源: 题型:
查看答案和解析>>【题目】0.1mol金属锡跟100mL12mol/LHNO3共热一段时间,完全反应后放出气体0.4mol,测定溶液c(H+)=8mol/L,溶液体积仍为100mL。由此推断氧化产物可能是
A. Sn(NO3)2 B. Sn(NO3)4
C. SnO24H2O D. Sn(NO3)2和Sn(NO3)4
-
科目: 来源: 题型:
查看答案和解析>>【题目】NA表示阿伏加德罗常数,下列叙述中正确的是( )
A. 常温常压下,48g O3所含的原子数为3NA
B. 1mol NH3所含有的原子数为NA
C. 标准状况下,22.4L水中所含原子数为3 NA
D. 0.1mol/L NaC1溶液中所含Na+数目为0.1 NA
-
科目: 来源: 题型:
查看答案和解析>>【题目】关于氨基酸的叙述错误的是( )
A. 氨基酸的结构中都含有氨基和羧基
B. 人体内氨基酸代谢的最终产物是二氧化碳和尿素
C. 人体内所有氨基酸都可以相互转化
D. 两个氨基酸通过脱水缩合形成二肽
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列各组离子中,能在无色透明溶液中大量共存的是
A. Na+、H+、Cl-、OH- B. K+、Na+、CO32-、OH-
C. K+、SO42-、NO3-、MnO4- D. Na+、HCO3-、H+、Ca2+
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列物质的工业制法正确的是
A.制钛:用金属钠置换出氯化钛(TiCl4)溶液中的钛
B.炼铁:炼铁高炉中碳在高温下还原铁矿石中的铁
C.制钠:用海水作原料制得精盐,再电解熔融的氯化钠得到金属钠
D.炼硅:用焦炭与二氧化硅在高温下反应生成粗硅和二氧化碳
相关试题

