【题目】A、B、C、D、E、F六种元素位于短周期,原子序数依次增大,C基态原子核外有三个未成对电子,B与D形成的化合物BD与C的单质C2电子总数相等,CA3分子结构为三角锥形,D与E可形成E2D与E2D2两种离子化合物,D与F是同族元素。根据以上信息,回答下列有关问题:
(1)写出基态时D的电子排布图_______________________。
(2)写出化合物E2F2的电子式________,化合物ABC的结构式________。
(3)根据题目要求完成以下填空:BF32-中心原子杂化方式________;D3中心原子杂化方式________;FD42-微粒中的键角________;FD3分子的立体构型________。
(4)根据等电子原理,指出与BD2互为等电子体且含有C原子的微粒有________、________(要求写一种分子和一种离子)。
参考答案:
【答案】(18分,每空2分)(1)![]()
(2)![]() ;H-C≡N
;H-C≡N
(3)sp2杂化 sp2杂化 109°28′ 平面三角形 (4)N2OOCN-或SCN-或N3-
【解析】
试题A、B、C、D、E、F六种元素位于短周期,原子序数依次增大,C基态原子核外有三个未成对电子,且C能形成单质C2,所以C是N元素;B与D形成的化合物BD与C的单质C2电子总数相等,且C的原子序数大于B小于D,所以B是C元素,则D是O元素;CA3分子结构为三角锥形,且A的原子序数小于B,所以A是H元素;D与E可形成E2D与E2D2两种离子化合物,所以E是Na元素;D与F是同族元素,所以F是S元素。则
(1)根据以上分析知,D是O元素,原子核外有8个电子,其核外电子排布图为
![]() ;
;
(2)化合物Na2S2是离子化合物,和过氧化钠结构相似,所以根据过氧化钠的电子式可知,该化合物的电子式为![]() ;化合物ABC是氢氰酸,结构式为H-C≡N;
;化合物ABC是氢氰酸,结构式为H-C≡N;
(3)杂化轨道数=σ键个数+孤电子对数,则BF32-中心原子杂化轨道数=3+0=3,采取sp2杂化;O3中心原子杂化轨道数=3,采取sp2杂化;SO42-微粒中价层电子对数=4+0=4,所以它的VSEPR模型为正四面体,因为没有孤电子对,所以其空间构型为正四面体,键角是109°28′;SO3分子中价层电子对数=3+0=3,所以它的VSEPR模型为平面三角形,由于没有孤电子对,其空间构型为平面三角形。
(4)原子数与价电子数分别都相等的是等电子体,因此与CO2互为等电子体且含有N原子的微粒有N2O、OCN-或SCN-或N3-等。
-
科目: 来源: 题型:
查看答案和解析>>【题目】以TiO2为催化剂的光热化学循环分解CO2反应为温室气体减排提供了一个新途径,该反应的机理及各分子化学键完全断裂时的能量变化如下图所示。
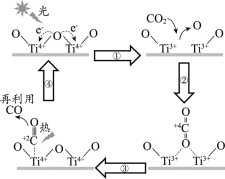
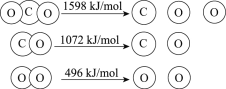
下列说法正确的是
A.过程①中钛氧键断裂会释放能量
B.该反应中,光能和热能转化为化学能
C.使用TiO2作催化剂可以降低反应的焓变,从而提高化学反应速率
D.CO2分解反应的热化学方程式为2CO2(g) =2CO(g) + O2(g) ΔH= + 30 kJ/mol
-
科目: 来源: 题型:
查看答案和解析>>【题目】“太阳-水”电池装置如图所示,该电池由三个电极组成,其中a为TiO2电极,b为Pt电极,c为WO3电极,电解质溶液为pH=3的Li2SO4-H2SO4溶液。锂离子交换膜将电池分为A、B两个区,A区与大气相通,B区为封闭体系并有N2保护。下列关于该电池的说法正确的是( )
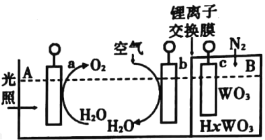
A.若用导线连接a、c,则a为负极,该电极附近pH增大
B.若用导线连接a、c,则c电极的电极反应式为HxWO3-xe-=WO3+xH+
C.若用导线先连接a、c,再连接b、c,可实现太阳能向电能转化
D.若用导线连接b、c,b电极的电极反应式为O2+4H++4He-=2H2O
-
科目: 来源: 题型:
查看答案和解析>>【题目】(1)元素C、N、O、K的电负性从大到小依次为______。
(2)CH4中共用电子对偏向C,SiH4中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为______。
(3)下图是周期表中短周期的一部分,A的单质是空气中含量最多的物质,其中第一电离能最小的元素是______(填“A”“B”“C”或“D”)。
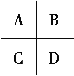
(4)氮化硼(BN)是一种重要的功能陶瓷材料。基态B原子的电子排布式为______;B和N相比,电负性较大的是______,BN中B元素的化合价为______。
-
科目: 来源: 题型:
查看答案和解析>>【题目】高铁酸钾(K2FeO4)是一种优良的水处理剂。25℃,其水溶液中加酸或碱改变溶液的pH时,含铁粒子的物质的量分数δ(X)随pH的变化如图所示[已知
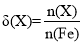 ]。下列说法正确的是( )
]。下列说法正确的是( )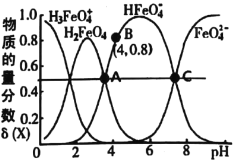
A.K2FeO4、H2FeO4都属于强电解质
B.由B点数据可知,H2FeO4的第一步电离常数Ka1=4.0×10-4
C.25℃,H2FeO4(aq)+H+
 H3FeO4+(aq)的平衡常数K>100
H3FeO4+(aq)的平衡常数K>100D.A、C两点对应溶液中水的电离程度不相等
-
科目: 来源: 题型:
查看答案和解析>>【题目】在一定温度下,向a L密闭容器中加入1 mol X气体和2 mol Y气体,发生如下反应:X(g)+2Y(g)
 2Z(g),不能说明此反应达到平衡的标志是( )
2Z(g),不能说明此反应达到平衡的标志是( )A.容器内压强不随时间变化
B.容器内各物质的百分含量不随时间变化
C.容器内X、Y、Z的浓度之比为1:2:2
D.v正(X)=2v逆(Y)
-
科目: 来源: 题型:
查看答案和解析>>【题目】2019年诺贝尔化学奖授予三位开发锂离子电池的科学家。TiS2、LiCoO2、LiFePO4、LiMnO2、Cu与磷的化合物等都是研究电池的常用材料。请回答下列问题。
(1)Co4+中存在__种不同能量的电子。
(2)你预测第一电离能:Cu__Zn(填“>”或“<”)。请说出你的理由:__。
(3)已知下列化合物的熔点:
化合物
AlF3
GaF3
AlCl3
熔点/℃
1040
1000
194
表格中卤化物的熔点产生差异的原因是:___。
(4)直链多磷酸盐的阴离子有复杂的结构,焦磷酸根离子、三磷酸根离子结构如图:

这类磷酸根离子的化学式可用通式表示为___(用n代表P原子数)。
(5)钴蓝晶胞结构如图1所示,该立方晶胞由4个Ⅰ型和4个Ⅱ型小立方体构成如图2,则钴蓝晶体的化学式为___。在晶体中,某些原子位于其它原子围成的空隙中,如图3中●原子就位于最近的4个原子围成的正四面体空隙中。在钴蓝晶体中,Al3+位于O2-形成的___空隙中。若阿伏加德罗常数用NA表示,则钴蓝晶体的密度为___g·cm-3(列计算式即可,不必化简)。

相关试题

