【题目】铅蓄电池反应为:Pb + PbO2 + 2H2SO4![]() 2PbSO4 + 2H2O 。下列说法中正确的是
2PbSO4 + 2H2O 。下列说法中正确的是
A. PbO2得电子,被氧化
B. 铅蓄电池工作过程中每通过2mol电子,负极质量减少207g
C. 电流是由PbO2经外电路流向Pb
D. 电池放电时,溶液酸性增强
参考答案:
【答案】C
【解析】
试题A.由铅蓄电池的总反应Pb + PbO2+ 2H2SO4![]() 2PbSO4+ 2H2O可知,放电时,正极上PbO2得电子被还原,A项错误;B.铅蓄电池的负极反应为Pb-2e-+SO42-=PbSO4,负极质量增加96g,B项错误;C. 电子的流向和电流的方向相反,则电流是由PbO2经外电路流向Pb,C项正确;D.根据铅蓄电池总反应为:Pb + PbO2+ 2H2SO4
2PbSO4+ 2H2O可知,放电时,正极上PbO2得电子被还原,A项错误;B.铅蓄电池的负极反应为Pb-2e-+SO42-=PbSO4,负极质量增加96g,B项错误;C. 电子的流向和电流的方向相反,则电流是由PbO2经外电路流向Pb,C项正确;D.根据铅蓄电池总反应为:Pb + PbO2+ 2H2SO4![]() 2PbSO4+ 2H2O,放电时,消耗硫酸,浓度减小,酸性减弱,D项错误;答案选C。
2PbSO4+ 2H2O,放电时,消耗硫酸,浓度减小,酸性减弱,D项错误;答案选C。
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图所示,将镁片、铝片平行插入一定浓度的NaOH溶液中,用导线连成闭合回路,该装置在工作时,下列叙述中正确的是
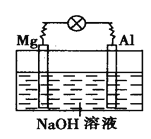
A. 镁比铝活泼,镁失去电子被氧化成Mg2+
B. 铝是电池的负极,开始工作时溶液中会立即有白色沉淀生成
C. 该装置的内、外电路中,均是电子的定向移动形成
D. 该装置开始工作时,铝片表面的氧化膜可不必处理
-
科目: 来源: 题型:
查看答案和解析>>【题目】在2L密闭容器中,发生3A(g)+B(g)
 2C(g)的反应,若最初加入A和B都是4mol, A的平均反应速率为0.12mol·L﹣1·s﹣1,则10s后容器中B的物质的量是
2C(g)的反应,若最初加入A和B都是4mol, A的平均反应速率为0.12mol·L﹣1·s﹣1,则10s后容器中B的物质的量是A. 1.6 mol B. 2.8 mol C. 3.2 mol D. 3.6 mol
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向水槽中滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验中不考虑两球的浮力变化)

A. 杠杆为导体或绝缘体时,均为A端高B端低
B. 杠杆为导体或绝缘体时,均为A端低B端高
C. 当杠杆为导体时,A端低B端高;杠杆为绝缘体时,A端高B端低
D. 当杠杆为导体时,A端高B端低;杠杆为绝缘体时,A端低B端高
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列关于硅的说法不正确的是( )
A.硅是非金属元素,但它的单质是灰黑色有金属光泽的固体
B.硅的导电性能介于金属和绝缘体之间,是良好的半导体材料
C.硅的化学性质不活泼,常温下不与任何物质起反应
D.当加热到一定温度时,硅能与氧气、氢气等非金属反应
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列物质与硫酸铁不反应的是( )
①稀硝酸 ②碳酸氢钠溶液 ③碘化钾溶液
④偏铝酸钠溶液 ⑤硫氰化钾溶液 ⑥酸性高锰酸钾溶液
A. ①⑥ B. ④⑥ C. ③④ D. ①④⑥
-
科目: 来源: 题型:
查看答案和解析>>【题目】右下表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素的核电荷数为X元素的2倍。下列说法正确的是( )
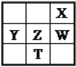
A. X、W、Z元素的原子半径及它们的气态氢化物的热稳定性均依次递增
B. Y、Z、W元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增
C. YX2晶体熔化、液态WX3气化均需克服分子间作用力
D. 根据元素周期律,可以推测T元素的单质具有半导体特性,T2X3具有氧化性和还原性
相关试题

