【题目】NA为阿伏加德罗常数,下列有关说法正确的是
A.常温下,7.8g固体Na2O2中,含有的阴阳离子总数为0.4 NA
B.4.48L氨气分子中含0.6NA个N-H键
C.铁、Cu片、稀硫酸组成的原电池,当金属铁质量减轻5.6g时,流过外电路的电子为0.3NA
D.4℃时,20g2H216O中含有共用电子对数为2NA
参考答案:
【答案】D
【解析】
试题A、7.8g过氧化钠的物质的量为:![]() =0.1mol,0.1mol过氧化钠中含有0.2mol钠离子、0.1mol过氧根离子,总共含有0.3mol离子,含有的阴阳离子总数为0.3NA,故A错误;B、不是标况下,不能使用标况下的气体摩尔体积计算4.48L氨气的物质的量,故B错误;C、5.6g铁的物质的量为:
=0.1mol,0.1mol过氧化钠中含有0.2mol钠离子、0.1mol过氧根离子,总共含有0.3mol离子,含有的阴阳离子总数为0.3NA,故A错误;B、不是标况下,不能使用标况下的气体摩尔体积计算4.48L氨气的物质的量,故B错误;C、5.6g铁的物质的量为:![]() =0.1mol,0.1mol铁与稀硫酸反应生成0.2mol电子,根据电子守恒,流过外电路的电子为0.2NA,故C错误;D、20g2H216O的物质的量为:
=0.1mol,0.1mol铁与稀硫酸反应生成0.2mol电子,根据电子守恒,流过外电路的电子为0.2NA,故C错误;D、20g2H216O的物质的量为:![]() =1mol,1mol水分子中含有2mol氧氢键,所以含有共用电子对数为2NA,故D正确;故选D。
=1mol,1mol水分子中含有2mol氧氢键,所以含有共用电子对数为2NA,故D正确;故选D。
-
科目: 来源: 题型:
查看答案和解析>>【题目】(实验题)为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验)
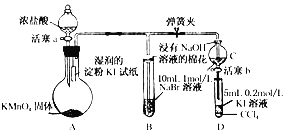
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a
Ⅳ.……
(1)A中产生黄绿色气体,其电子式是____________________
(2)验证氯气的氧化性强于碘的实验现象是____________________
(3)B中溶液发生反应的离子方程式是____________________
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是__________________________________________
(5)过程Ⅲ实验的目的是____________________
(6)氯溴碘单质的氧化性逐渐减弱的原因:同主族元素从上到下_________,得电子能力逐渐减弱
-
科目: 来源: 题型:
查看答案和解析>>【题目】关于下列粒子的描述不正确的是( )
A. PH3的电子式为
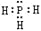 ,其热稳定性不如NH3
,其热稳定性不如NH3B. HS-的电子式为
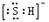 ,是含有极性键的18电子的粒子
,是含有极性键的18电子的粒子C. CH2Cl2的电子式为
 ,是结构呈正四面体的分子
,是结构呈正四面体的分子D. KF的电子式为
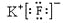 ,它是易溶于水的离子化合物
,它是易溶于水的离子化合物 -
科目: 来源: 题型:
查看答案和解析>>【题目】某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。下列说法错误的是

A. ②的作用是安全瓶
B. ③中试剂更换为Ba(NO3)2后,无明显现象发生
C. ④中的现象说明SO2具有氧化性
D. ⑤用于检验SO2的漂白性
-
科目: 来源: 题型:
查看答案和解析>>【题目】在“观察DNA和RNA在细胞中的分布”实验中,使用盐酸的目的是 ( )
①改变细胞膜的流动性
②改变细胞膜的通透性
③改变细胞膜的化学组成
④将DNA与蛋白质分离
⑤将RNA与蛋白质分离
⑥利于RNA与染色剂结合
⑦利于蛋白质与染色剂结合
⑧利于DNA与染色剂结合
A.①④⑥ B.②④⑧ C.③⑤⑦ D.②⑤⑥
-
科目: 来源: 题型:
查看答案和解析>>【题目】反应Fe(s)+CO2(g)FeO(s)+CO(g),700℃时平衡常数为1.47,900℃时平衡常数为2.15.下列说法正确的是( )
A.升高温度该反应的正反应速率增大,逆反应速率减小
B.该反应的化学平衡常数表达式为K=
C.该反应的正反应是吸热反应
D.增大CO2浓度,平衡常数增大 -
科目: 来源: 题型:
查看答案和解析>>【题目】下列有关物质性质的比较顺序中,不正确的是

A. 热稳定性:HF<HCl<HBr<HI B. 微粒半径:K+>Na+>Mg2+>Al3+
C. 酸性:HClO4>H2SO4>H3PO4>H2SiO3 D. 最外层电子数:Li<Mg<Si<Ar
相关试题

